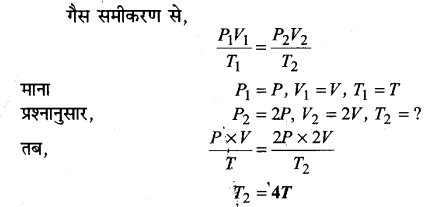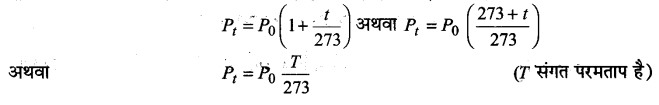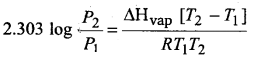NCERT Solutions Class 11 रसायन विज्ञान Chapter-5 (द्रव्य की अवस्थाएँ)
Class 11 (रसायन विज्ञान )
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
पाठ-5 (द्रव्य की अवस्थाएँ)
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
30°C तथा 1 bar दाब पर वायु के 50 dm आयतन को 200 dm तक संपीडित करने के लिए कितने न्यूनतम दाब की आवश्यकता होगी?
उत्तर :
प्रश्न 2.
35°C ताप तथा 1.2 bar दाब पर 120 mL धारिता वाले पात्र में गैस की निश्चित मात्रा भरी है। यदि 35°C पर गैस को 180 mL धारिता वाले फ्लास्क में स्थानान्तरित किया जाता है तो गैस का दाब क्या होगा?
उत्तर :
प्रश्न 3.
अवस्था-समीकरण का उफ्योग करते हुए स्पष्ट कीजिए कि दिए गए ताप पर गैस का घनत्व गैस के दाब के समानुपाती होता है।
उत्तर :
प्रश्न 4.
0°C पर तथा 2 bar दाब पर किसी गैस के ऑक्साइड का घनत्व 5 bar दाब पर डाइनाइट्रोजन के घनत्व के समान है तो ऑक्साइड का अणुभार क्या है?
उत्तर :
प्रश्न 5.
27°C पर एक ग्राम आदर्श गैस का दाब 2 bar है। जब समान ताप एवं दाब पर इसमें दो ग्राम आदर्श गैस मिलाई जाती है तो दाब 3 bar हो जाता है। इन गैसों के अणुभार में सम्बन्ध स्थापित कीजिए।
उत्तर :
प्रश्न 6.
नाली साफ करने वाले ड्रेनेक्स में सूक्ष्म मात्रा में ऐलुमिनियम होता है। यह कॉस्टिक सोडा से क्रिया पर डाइहाइड्रोजन गैस देता है। यदि 1 bar तथा 20°C ताप पर 0.15 g ऐलुमिनियम अभिक्रिया करेगा तो निर्गमित डाइहाइड्रोजन का आयतन क्या होगा?
उत्तर :
प्रश्न 7.
यदि 27°C पर 9 dm धारिता वाले फ्लास्क में 3.2 ग्राम मेथेन तथा 4.4 ग्राम कार्बन डाइऑक्साइड का मिश्रण हो तो इसका दाब क्या होगा?
उत्तर :
प्रश्न 8.
27°C ताप पर जब 1L के फ्लास्क में 0.7 bar पर 2.0L डाइऑक्सीजन तथा 0.8 bar पर 0-5 L डाइहाइड्रोजन को भरा जाता है तो गैसीय मिश्रण का दाब क्या होगा?
उत्तर :
प्रश्न 9.
यदि 27°C ताप तथा 2 bar दाब पर एक गैस का घनत्व 5.46 g/dm’ है तो STP पर इसका घनत्व क्या होगा?
उत्तर :
प्रश्न 10.
यदि 546°C तथा 0.1 bar दाब पर 34.05 mL फॉस्फोरस वाष्प का भार 0.0625 g है तो फॉस्फोरस का मोलर द्रव्यमान क्या होगा?
उत्तर :
प्रश्न 11.
एक विद्यार्थी 27°C पर गोल पेंदे के फ्लास्क में अभिक्रिया-मिश्रण डालना भूल गया तथा उस फ्लास्क को ज्वाला पर रख दिया। कुछ समय पश्चात उसे अपनी भूल का अहसास हुआ। उसने उत्तापमापी की सहायता से फ्लास्क का ताप 477°C पाया। आप बताइए कि वायु का कितना भाग फ्लास्क से बाहर निकला?
उत्तर :
प्रश्न 12.
3.32 bar पर 5 dm आयतन घेरने वाली 4.0 mol गैस के ताप की गणना कीजिए। (R = 0.083 bar dm3 K-1mol-1)
उत्तर :
प्रश्न 13.
1.4g डाइनाइट्रोजन गैस में उपस्थित कुल इलेक्ट्रॉनों की संख्या की गणना कीजिए।
उत्तर :
प्रश्न 14.
यदि एक सेकण्ड में 100 गेहूँ के दाने वितरित किए जाएँ तो आवोगाद्रो संख्या के बराबर दाने वितरित करने में कितना समय लगेगा?
उत्तर :
आवोगाद्रो की संख्या = 6.022×1023। चूँकि 1010 दाने प्रति सेकण्ड वितरित होते हैं,
प्रश्न 15.
27°C ताप पर 1 dm3आयतन वाले फ्लास्क में 8 ग्राम डाइऑक्सीजन तथा 4 ग्राम डाइहाइड्रोजन के मिश्रण का कुल दाब कितना होगा?
उत्तर :
प्रश्न 16.
गुब्बारे के भार तथा विस्थापित वायु के भार के अन्तर को ‘पेलोड कहते हैं। यदि27°C पर 10 m त्रिज्या वाले गुब्बारे में 1.66 bar पर 100 kg हीलियम भरी जाए तो पेलोड की गणना कीजिए। (वायु का घनत्व = 1.2 kg m3 तथा R = 0.083 bar dm3 K-1mol-1)
उत्तर :
प्रश्न 17.
31.1°C तथा 1 bar दाब पर 8.8 ग्राम CO2) द्वारा घेरे गए आयतन की गणना कीजिए। (R = 0.083 bar LK-1mol-1)
उत्तर :
प्रश्न 18.
समान दाब पर किसी गैस के 2.9 ग्राम द्रव्यमान का 95°C तथा 0.184 ग्राम डाइहाइड्रोजन का 17°C पर आयतन समान है। बताइए कि गैस का मोलर द्रव्यमान क्या होगा?
उत्तर :
प्रश्न 19.
1 bar दाब पर डाइहाइड्रोजन तथा डाइऑक्सीजन के मिश्रण में 20% डाइहाइड्रोजन (भार से) रखा जाता है तो डाइहाइड्रोजन का आंशिक दाब क्या होगा?
उत्तर :
प्रश्न 20.
PV2T2/n राशि के लिए S.I. इकाई क्या होगी?
उत्तर :
प्रश्न 21.
चार्ल्स के नियम के आधार पर समझाइए कि न्यूनतम सम्भव ताप -273°C होता है।
उत्तर :
जिस प्रकार गैस को गर्म करने पर उसका आयतन बढ़ता है ठीक उसी प्रकार उसे ठण्डा करने पर अर्थात् उसका ताप घटाने पर उसका आयतन घटता भी है। ऐसी स्थिति में,
अतः -273°C पर गैस का आयतन शून्य हो जाना चाहिए।
इससे कम ताप पर आयतन ऋणात्मक हो जाएगा जो कि अर्थहीन है। वास्तव में सभी गैसें इस ताप पर पहुँचने से पउत्तरे ही द्रवित हो जाती हैं। इससे यह निष्कर्ष निकलता है कि -273°C (0K) ही न्यूनतम सम्भव ताप है।
प्रश्न 22.
कार्बन डाइऑक्साइड तथा मेथेन का क्रान्तिक ताप क्रमशः 31.1°C एवं -81.9°C है। इनमें से किसमें प्रबल अन्तर-आण्विक बल है तथा क्यों?
उत्तर :
क्रान्तिक ताप जितना अधिक होगा, गैस को उतनी ही सरलता से द्रवीभूत किया जा सकता है। यह केवल तब सम्भव है जब अन्तर आणविक बल मजबूत हो। अत: CO2में, CH4 की तुलना में प्रबल अन्तराणविक बल है।
प्रश्न 23.
वाण्डरवाल्स प्राचल की भौतिक सार्थकता को समझाइए।
उत्तर :
- वाण्डरवाल्स प्राचल ‘a’-इसका मान गैस के अणुओं में विद्यमान आकर्षण बलों के परिमाण की माप होता है। अत: a का मान अधिक होने का तात्पर्य, अन्तर-आण्विक आकर्षण बलों का अधिक होना है।
- वाण्डरवाल्स प्राचल ‘b’-इसका मान गैस-अणुओं के प्रभावी आकार की माप है। इसका मान गैस-अणुओं के वास्तविक आयतन का चार गुना होता है। यह अपवर्जित आयतन कउत्तराता है।
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
गैस के किसी निश्चित भार के लिए यदि दाब को आधा तथा ताप को दोगुना कर दिया जाए, तो गैस का आयतन होगा ।
(i) V/4 ,
(ii) 2V2
(iii) 6V
(iv) 4V
उत्तर :
(iv) 4V
प्रश्न 2.
स्थिर दाब पर ऐक लीटर धारिता वाले पात्र को 27°C से 37°C तक गर्म किया जाता है। बाहर निकलने वाली वायु का आयतन है।
(i) 22.2 लीटर
(ii) 0.333 लीटर
(iii) 0.222 लीटर
(iv) 33.3 लीटर
उत्तर :
(iv) 33.3 लीटर
प्रश्न 3.
27°C पर एक गैस का दाब 90 सेमी है। स्थिर आयतन पर -173°C ताप पर गैस का दाब होगा
(i) 30 सेमी
(ii) 40 सेमी
(iii) 60 सेमी
(iv) 68 सेमी
उत्तर :
(i) 30 सेमी
प्रश्न 4.
एक बर्तन में 25°C पर मेथेन तथा हाइड्रोजन के समान भार भरे गए हैं। हाइड्रोजन का दाब होगा, कुल दाबे का
उत्तर :
(ii)
प्रश्न 5.
किसी गैस के 0.1 ग्राम का सा० ता० दा० पर आयतन 20 मिली है। इस गैस का अणुभार है।
(i) 56
(ii) 40
(iii) 80
(iv) 60
उत्तर :
(iii) 80
प्रश्न 6.
ऑक्सीजन के 16 ग्राम तथा हाइड्रोजन के 3 ग्राम को मिलाया गया और 760 मिमी दाब तथा 273 K ताप पर एक बर्तन में रखा गया। मिश्रण द्वारा घेरा गया कुल आयतन होगा
(i) 22.4 लीटर
(ii) 33.6 लीटर
(iii) 11.2 लीटर
(iv) 44.8 लीटर
उत्तर :
(iv) 44.8 लीटर
प्रश्न 7.
एक मिश्रण का कुल दाब ‘P’ है। इस मिश्रण में 5.6 ग्राम नाइट्रोजन और 6.4 ग्राम ऑक्सीजन है। मिश्रण में नाइट्रोजन का आंशिक दाब है।
उत्तर :
(ii)
प्रश्न 8.
समान धारिता वाले दो फ्लास्कों में 500 मिमी दाब पर नाइट्रोजन एवं 250 मिमी दाब पर हाइड्रोजन भरी है। दोनों पात्रों को जोड़ देने पर सम्पूर्ण मिश्रण का दाब होगा
(i) 500 मिमी
(ii) 375 मिमी
(iii) 250 मिमी
(iv) इनमें से कोई नहीं
उत्तर :
(ii) 375 मिमी
प्रश्न 9.
निम्नलिखित में किस गैस का द्रवीकरण आसानी से होता है?
(i) NH3
(ii) SO2
(iii) H2
(iv) CO2
उत्तर :
(i) NH3
प्रश्न 10.
जिस ताप पर द्रव का वाष्प दाब वायुमण्डलीय दाब के बराबर हो जाता है, उसे कहा जाता
(i) हिमांक
(ii) क्वथनांक
(iii) गलनांक
(iv) क्रान्तिक ताप
उत्तर :
(ii) क्वथनांक
प्रश्न 11.
किसी द्रव की पृष्ठ तनाव
(i) ताप वृद्धि से बढ़ता है।
(ii) ताप वृद्धि से घटता है।
(iii) ताप का कोई प्रभाव नहीं होता है
(iv) कोई उत्तर सही नहीं है।
उत्तर :
(ii) ताप वृद्धि से घटती है।
प्रश्न 12.
एक द्रव और जल के समान आयतन द्वारा एक बिन्दुमापी से क्रमशः 40 और 20 बूंदें बनाईं गईं। द्रव और जल के घनत्वों का अनुपात 2:1 है। यदि जल का पृष्ठ तनाव 7.2 x10-2न्यूटन/मीटर है, तो द्रव का पृष्ठ तनाव होगा।
(i) 14.4×10-2 न्यूटन/मीटर।
(ii) 28.8 x 10-2 न्यूटन/मीटर
(iii) 7.2×10-2 न्यूटन/मीटर
(iv) 0.36×10-2 न्यूटन/मीटर
उत्तर :
(iii) 7.2 x 10-2 न्यूटन/मीटर
प्रश्न 13.
श्यानता की S.I. इकाई है।
(i) पॉइज
(ii) पास्कल
(iii) डाइन सेमी-2
(iv) न्यूटन सेमी-2
उत्तर :
(ii) पास्कल
प्रश्न 14.
श्यानता गुणांक के C.G.S. और S.I. मात्रक में सम्बन्ध है।
(i) 1 पॉइज = 10 पास्कल-सेकण्ड
(ii) 1 पॉइज = 10-1 पास्कल-सेकण्ड
(iii) 1 पॉइज = 10-2 पास्कल-सेकण्ड
(iv) 1 पॉइज = 102 पास्कल-सेकण्ड
उत्तर :
(ii) 1 पॉइज = 10-1 पास्कल-सेकण्ड
प्रश्न 15.
किसकी श्यानता अधिकतम है?
(i) ऐल्कोहॉल
(ii) ईथर
(iii) ग्लाइकॉल
(iv) ग्लिसरॉल
उत्तर :
(iv) ग्लिसरॉल
प्रश्न 16.
श्यानता के सन्दर्भ में कौन-सा कथन असत्य है?
(i) दाब बढ़ाने पर श्यानता घटती है।
(ii) जल में सुक्रोस मिलाने पर श्यानता बढ़ती है।
(iii) जल में KCI मिलाने पर श्यानता घटती है।
(iv) ताप बढ़ाने पर श्यानता घटती है।
उत्तर :
(i) दाब बढ़ाने पर श्यानता घटती है।
प्रश्न 17.
किसकी श्यानता अधिकतम होगी?
(i) (C2H5)2O
(ii) C2H5OH
(iii) C4H9OH
(iv) (CH3)2O
उत्तर :
(iii) C4H9OH
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
15°C पर एक गैस का आयतन 360 मिली है। यदि दाब स्थिर है, तो किस ताप पर उसका आयतन 400 मिली हो जाएगा?
उत्तर :
प्रश्न 2.
स्थिर दाब तथा 127°C ताप पर एक गैस का आयतन किस ताप पर दोगुना हो जायेगा?
उत्तर :
प्रश्न 3.
गैस समीकरण PV = nRT में n क्या है? इसका मान कैसे निकालते हैं?
उत्तर :
गैस समीकरण PV=nRT में n गैस के मोलों की संख्या है। यदि गैस समीकरण PV = nRT में P,V, R तथा T के मान ज्ञात हों, तो n का मान निम्न सूत्र से ज्ञात कर लेते हैं।
प्रश्न 4.
किसी विशेष ताप पर किसी गैस का दाब, घनत्व से किस प्रकार सम्बन्धित होता है?
उत्तर :
ताप और दाब की स्थिर दशाओं में विभिन्न गैसों के घनत्व उनके मोलर द्रव्यमानों के समानुपाती होते हैं।
अर्थात्
प्रश्न 5.
गैस स्थिरांक के मान को S.I. मात्रकों में लिखिए।
उत्तर :
गैस स्थिरांक R का मान S.I. मात्रकों में 8314 JK-1mol-1 है।
प्रश्न 6.
1 ग्राम H2का S.T.P. पर आयतन क्या होगा?
उत्तर :
1 ग्राम H2में मोलों की संख्या=
∵ 1 मोल H2 का S.T.P. पर आयतन = 22.4 ली।
∴ 1 मोल H2का S.T.P. पर आयतन = ली
प्रश्न 7.
किसी गैस को इतना गर्म किया जाता है कि उसका दाब और आयतन दोनों दोगुना हो जाते हैं। गैस का नया परमताप क्या होगा?
उत्तर :
प्रश्न 8.
– 73°C ताप पर किसी गैस का दाब 1 वायुमण्डल है। यदि आयतन स्थिर रखा जाये, तो उसे किस ताप तक गर्म करें कि दाब दोगुना हो जाए?
उत्तर :
प्रश्न 9.
17°C ताप तथा 870 मिली दाब पर किसी गैस के निश्चित द्रव्यमान का आयतन 76 मिली है। मानक ताप तथा दाब पर उस गैस का आयतन क्या होगा?
उत्तर :
प्रश्न 10.
आदर्श गैस से आप क्या समझते हैं? गैस के किसी एक मोल के लिए आदर्श गैस समीकरण लिखिए।
उत्तर :
जो गैस ताप व दाब की सभी परिस्थितियों में बॉयल एवं चार्ल्स के नियम का तथा आदर्श गैस समीकरण का पालन करती है, उसे आदर्श गैस कहते हैं।
1 मोल गैस के लिए आदर्श गैस समीकरण इस प्रकार होगी
PV =nRT
यदि n = 1 मोल हो, तो
PV = RT
जहाँ, P = दाब, V = आयतन, R = सार्वत्रिक गैस स्थिरांक, T = परमताप
प्रश्न 11.
परमताप को समझाइए।
उत्तर :
273°C का वह न्यूनतम सम्भव परिकल्पित ताप जिस पर सभी गैसों को आयतन शून्य माना जाता है परमताप कउत्तराता है। वास्तव में प्रयोगों द्वारा परमताप का मान -27315°C ज्ञात हुआ है परन्तु सुविधा की दृष्टि से इसके सन्निकट मान -273°C का ही प्रयोग किया जाता है।
प्रश्न 12.
किन परिस्थितियों में आदर्श गैस आदर्श व्यवहार प्रदर्शित करती है?
उत्तर :
वह गैस जो सभी तापों और दाबों पर गैस के नियमों और आदर्श गैस समीकरण (PV = nRT) का पालन करती है आदर्श गैस कउत्तराती है परन्तु यह पाया गया है कि कोई भी गैस सभी तपों और दाबों पर गैस के नियमों तथा गैस समीकरण का पालन नहीं करती है अतः कोई भी गैस आदर्श नहीं है।
प्रश्न 13.
क्रान्तिक ताप की परिभाषा दीजिए।
उत्तर :
वह ताप जिसके नीचे दाब की वृद्धि करने से गैस द्रवित हो जाती है और जिसके ऊपर वह किसी भी दाब पर द्रवित नहीं होती है उसे क्रान्तिक ताप कहा जाता है। क्रान्तिक ताप को 7 से प्रदर्शित किया जाता है।
प्रश्न 14.
जलीय तनाव को परिभाषित कीजिए।
उत्तर :
किसी निश्चित ताप पर जल वाष्प द्वारा आरोपित दाब एक नियतांक होता है तथा इसे जलीय तनाव कहते हैं।
प्रश्न 15.
श्यानता गुणांक को परिभाषित कीजिए।
उत्तर :
किसी द्रव की श्यानता की परिमाणात्मक मापे उसका श्यानता गुणांक n (ईटा) होता है जिसे सामान्यतः द्रव की श्यानता कहते हैं।
द्रव की श्यानता (η) ताप पर निर्भर करती है। ताप वृद्धि के साथ श्यानता घटती है। इसकी इकाई पॉइज तथा S.I. मात्रक किलोग्राम प्रति मी/से या पास्कल-सेकण्ड है।
प्रश्न 16.
द्रव की श्यानता पर ताप तथा दाब के प्रभाव को समझाइए।
उत्तर :
1. द्रव की श्यानता पर ताप परिवर्तन का प्रभाव–ताप बढ़ाने पर द्रव की श्यानता का मान घटता है क्योंकि ताप बढ़ाने पर द्रव के अणुओं की औसत गतिज ऊर्जा बढ़ती है जिससे अन्तराणविक आकर्षण बल का मान कम हो जाता है।
2. द्रव की श्यानता पर दाब परिवर्तन का प्रभाव-दाब बढ़ाने पर द्रव के अणु निकट आ जाते हैं। ” जिसके कारण अन्तराणविक आकर्षण बल का मान बढ़ जाता है जिससे श्यानता बढ़ जाती है।
प्रश्न 17.
जल की तुलना में ग्लिसरीन धीरे-धीरे बहती है, क्यों?
उत्तर :
किसी द्रव के बहने का गुण द्रव की प्रकृति पर निर्भर करता है, क्योंकि द्रव के अणुओं के मध्य अन्तराणविक आकर्षण बलों का मान उच्च होने पर श्यानता का मान भी उच्च होता है जिससे बहने की दर कम हो जाती है। ग्लिसरीन के अणुओं के मध्य अन्तराणविक आकर्षण बल का मान जल के अणुओं के मध्य अन्तराणविक आकर्षण बल के मान से उच्च होता है अर्थात् ग्लिसरीन की श्यानता जल की श्यानता की तुलना में अधिक होती है।
लघु उत्तरीय प्रश्न
प्रश्न 1.
सम्बन्ध PV = nRT को निगमित कीजिए जहाँ R सार्वत्रिक गैस नियतांक है।
उत्तर :
प्रश्न 2.
आदर्श गैस और वास्तविक गैस में अंतर लिखिए।
उत्तर :
वह गैस जो सभी तापों और दाबों पर गैस के नियमों और आदर्श गैस समीकरण (PV =nRT) का पालन करती है आदर्श गैस कउत्तराती है जबकि ऐसी गैसें जो सभी तापों और दाबों पर आदर्श व्यवहार नहीं दर्शाती हैं वास्तविक गैसें कउत्तराती हैं।
वास्तव में कोई भी गैस आदर्श गैस नहीं है जबकि सभी गैसें वास्तविक गैसें हैं।
प्रश्न 3.
गतिज गैस समीकरण के प्रयोग से प्रदर्शित कीजिए कि गैस की प्रति मोल औसत गतिज ऊर्जा RT से दी जाती है।
उत्तर :
प्रश्न 4.
क्रान्तिक दाब तथा क्रान्तिक आयतन की व्याख्या कीजिए।
उत्तर :
क्रान्तिक दाब–किसी गैस को क्रान्तिक ताप पर द्रवित करने के लिए जिस न्यूनतम दाब की आवश्यकता होती है वह उस गैस का क्रान्तिक दाब कउत्तराता है। इसे Pe से प्रदर्शित करते हैं। क्रान्तिक ताप जितना कम होता है क्रान्तिक दाब भी उतना ही कम होता है।
क्रान्तिक आयतन–क्रान्तिक दाब तथा क्रान्तिक ताप पर किसी गैस के 1 मोल का आयतन उसका ” क्रान्तिक आयतन कउत्तराता है। इसे Vc द्वारा प्रदर्शित करते हैं।
प्रश्न 5.
वाष्पन तथा क्वथन में अन्तर बताइए।
उत्तर :
वाष्पन तथा क्वथन में निम्नलिखित अन्तर हैं-
प्रश्न 6.
ताप का निम्न पर क्या प्रभाव पड़ता है।
(1) द्रव का घनत्व,
(2) द्रव का पृष्ठ तनाव,
(3) द्रव का वाष्प दाब।
उत्तर :
- ताप बढ़ने पर अणुओं की गतिज ऊर्जा बढ़ जाती है जो अणुओं के मध्य अन्तराणविक आकर्षण बलों के विरुद्ध कार्य करके द्रव के आयतन में वृद्धि कर देती है। आयतन में वृद्धि के कारण द्रव का घनत्व घट जाता है। अतः ताप बढ़ाने पर द्रव का घनत्व घटता है। ताप घटाने पर इसका विपरीत होता है।
- ताप के बढ़ने पर अणुओं की औसत गतिज ऊर्जा बढ़ जाती है और उनके मध्य अन्तराणविक आकर्षण बल घट जाता है। इसलिए द्रव की सतह पर उपस्थित अणुओं को द्रव के अन्दर स्थित अणु कम आकर्षित करते हैं जिससे पृष्ठ तनाव घट जाता है। इसके ठीक विपरीत, ताप के घटने पर पृष्ठ तनाव बढ़ जाता है।
- अधिक ताप पर द्रव के अधिकं अणुओं के पास द्रव से बाहर निकलने के लिए पर्याप्त ऊर्जा होती है। जबकि कम ताप पर ऐसे अणु बहुत कम होते हैं इसलिए ताप बढ़ने पर द्रव का वाष्प दाब बढ़ जाता है। इसके ठीक विपरीत ताप घटने पर द्रव का वाष्प दाब घट जाता है।
विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
बॉयल का नियम क्या है? यह नियम ग्राफीय रूप से किस प्रकार सत्यापित होता है। इस नियम का क्या महत्त्व है?
उत्तर :
बॉयल का नियम (आयतन-दाब सम्बन्ध)-सन् 1962 में आयरिश भौतिक विज्ञानी राबर्ट बॉयल ने सर्वप्रथम गैस के आयतन और दाब में मात्रात्मक सम्बन्ध का अध्ययन किया। इस सम्बन्ध को बॉयल का नियम (Boyle’s law) कहते हैं। इस नियम के अनुसार, स्थिर ताप पर किसी गैस की निश्चित मात्रा का आयतन उसके दाब के व्युत्क्रमानुपाती होता है। यदि स्थिर ताप T पर किसी गैस की निश्चित मात्रा का आयतन V तथा उसको दाब P है तो बॉयल के नियमानुसार,
(जब ताप और द्रव्यमान स्थिर हैं)
अथवा अथवा PV=k (नियतांक)
जहाँ, k एक स्थिरांक (constant) है जिसका मान गैस की मात्रा, गैस के ताप और उन मात्रकों पर निर्भर करता है जिनके द्वारा P तथा V व्यक्त किए गए हैं।
उपर्युक्त समीकरण के आधार पर बॉयल नियम के अनुसार, स्थिर ताप पर गैस की निश्चित मात्रा के आयतन तथा दाब का गुणनफल स्थिर (constant) होता है।
माना किसी गैस की निश्चित मात्रा का ताप T पर आयतन , तथा दाब P2 है। अब यदि ताप T पर ही गैस का दाब , कर दिया जाए तथा इससे उसका आयतन V2 हो जाए तब बॉयल के नियम के अनुसार,
P1V1 = P2V2 = स्थिरांक (जब द्रव्यमान और ताप स्थिर हैं)
अथवा
यदि इस स्थिति में हमें इन चार चरों (variables) में से तीन के मान ज्ञात हों, तो चौथे का मान ज्ञात किया जा सकता है। बॉयल के नियम का ग्राफीय निरूपण बॉयल के नियम का ग्राफीय निरूपण निम्न प्रकार से किया जा सकता है।
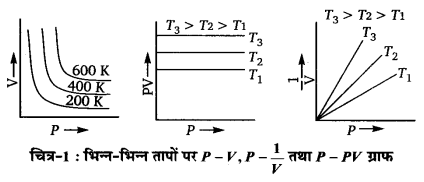
1.V तथा P के मध्य ग्राफ–नियत ताप पर किसी गैस की निश्चित मात्रा के आयतन (V) तथा दाब (P) के मध्य ग्राफ एक परवलय (hyperbola) होता है। यह दर्शाता है कि गैस का आयतन गैस के दाब का व्युत्क्रमानुपाती होता है।
2. PV तथा P के मध्य ग्राफ—यह ग्राफ़ X-अक्ष के समानान्तर एक सीधी रेखा होता है। यह ग्राफ दर्शाता है कि नियते ताप पर किसी गैस की निश्चित मात्रा के आयतन तथा दाब का गुणनफल स्थिरांक होता है।
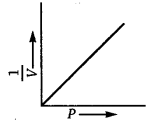
3.P तथा के मध्य ग्राफ—यह ग्राफ मूल बिन्दु से गुजरती हुई एक सीधी रेखा होता है। यह दर्शाता है कि नियत ताप पर गैस की निश्चित मात्रा के आयतन का व्युत्क्रम उसके दाब के अनुक्रमानुपाती होता है। अर्थात् गैस का आयतन उसके दाब के व्युत्क्रमानुपाती होता है।
जैसा कि आप जानते हैं बॉयल नियम के अनुसार,
PV=k
तथा k का मान गैस के द्रव्यमान तथा ताप दोनों पर निर्भर करता है। इसलिए किसी गैस की निश्चित मात्रा के लिए भिन्न-भिन्न तापों परवक्र तथा P-PV वक्र भिन्न-भिन्न आते हैं। एक ही ताप से सम्बन्धित वक्र समतापी (isothermal) कउत्तराता है। विभिन्न ग्राफों के वक्र नीचे दर्शाए गए हैं।
बॉयल के नियम का महत्त्व
बॉयल का नियम दर्शाता है कि गैसों को सम्पीडित किया जा सकता है। जब किसी गैस की निश्चित मात्रा को सम्पीडित किया जाता है तो उसके अणु कम स्थान घेरते हैं अर्थात् गैस अधिक सघन हो जाती है।
अतः कहा जा सकता है कि नियते ताप’ पर गैस की निश्चित मात्रा के लिए, गैस का घनत्व उसके दाब के समानुपाती होता है।
समुद्र-तल के पास की वायु पर उसके ऊपर स्थिर वायु का दाब होता है जबकि पर्वतों की वायु पर यह दाब कम होता है इसलिए समुद्र-तल के पास की वायु अधिक सघन तथा पर्वतों की वायु कम सघन होती है। यही कारण है कि पर्वतों पर कम ऑक्सीजन उपलब्ध होती है जिसके कारण वहाँ पर सिरदर्द, बेचैनी आदि होने लगती है। इससे बचने के लिए ही पर्वतारोही अपने साथ पर्वतों पर ऑक्सीजन के सिलेण्डर ले जाते हैं। इसी कारण से ऊँचाई पर उड़ने वाले वायुयानों में सामान्य दाब रखा जाता है। दाब के कम होने पर इनमें ऑक्सीजन उपलब्ध कराने की भी व्यवस्था होती है।
हीलियम के गुब्बारों को केवल आधा भरा जाता है। यदि इन्हें पूरा भर दिया जाए तो ऊपर जाकर दाब कम होने के कारण इनमें भरी गैस का आयतन बढ़ जाता है जिससे वे फट जाते हैं।
प्रश्न 2.
चार्ल्स का नियम क्या है? यह नियम ग्राफीय रूप से किस प्रकार सत्यापित होता है? इस नियम का क्या महत्त्व है?
उत्तर :
चार्ल्स का नियम (ताप-आयतन सम्बन्ध)-स्थिर दाब पर किसी गैस के आयतन में ताप के साथ परिवर्तन का अध्ययन सर्वप्रथम फ्रांसीसी रसायनज्ञ जैक्स चार्ल्स (Jacques Charles) ने सन् 1787 में किया। बाद में इस सम्बन्ध का अध्ययन जोसफ गै-लुसैक ने भी किया। इनके प्रेक्षणों के आधार पर प्रतिपादित नियम को चार्ल्स का नियम कहते हैं जिसके अनुसार, स्थिर दाब पर किसी गैस की निश्चित मात्रा का आयतन ताप के प्रत्येक 1°C बढ़ने या घटने पर उसके 0°C ताप के आयतन का 1/273 वाँ भाग बढ़ या घट जाता है।
यदि किसी गैस का 0°C पर आयतन , तथा १°C पर आयतन है, तब चार्ल्स के नियमानुसार,
इस प्रकार यदि गैस की निश्चित मात्रा का 0°C पर आयतन ज्ञात हो, तो किसी अन्य ताप पर उसका आयतन ज्ञात किया जा सकता है।
चार्ल्स के नियम का ग्राफीय निरूपण
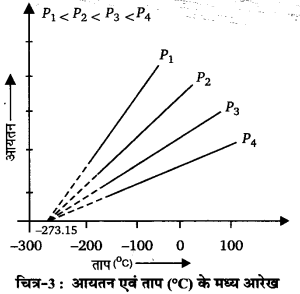
जब स्थिर दाब पर किसी गैस की निश्चित मात्रा के आयतन तथा ताप के मध्य ग्राफ खींचा जाता है, तो एक सीधी रेखा (straight line) प्राप्त होती है।
जब इस सीधी रेखा को नीचे की ओर बढ़ाते हैं, तो यह रेखा X-अक्ष अर्थात् ताप के अक्ष को -273°C पर काटती है। यह दर्शाता है कि एक गैस का आयतन -273°C पर शून्य होता है। इससे कम ताप पर गैस का आयतन ऋणात्मक होता है जो कि असम्भव है। गैस की निश्चित मात्रा के लिए, प्रत्येक दाब पर V-t वक्र अलग होता है। जब दाब कम होता है, तो रेखा का ढाल अधिक होता है तथा जब दाब अधिक होता है, तो रेखा को ढाल कम होता है। स्थिर दाब पर खींची गई प्रत्येक V- t रेखा को समदाबी रेखा (isobar) कहते हैं। ऊपर दिए गए ग्राफ में प्रत्येक रेखा समदाबी है।
चाल्र्स के नियम का महत्त्व
गुब्बारों में गर्म वायु का प्रयोग चार्ल्स के नियम पर ही आधारित है। चार्ल्स के नियम के अनुसार, ताप बढ़ने पर गैस का आयतन बढ़ता है। चूंकि गैस का द्रव्यमान वही रहता है इसलिए गैस का घनत्व कम हो जाता है। इसलिए गर्म वायु ठंडी वायु से कम सघन होती है। इसी कारण से गर्म वायु वाले गुब्बारे वायुमण्डल को ठण्डी वायु को विस्थापित करके ऊपर उठ पाते है।
प्रश्न 3.
गै-लुसैक का नियम क्या है? विस्तृत वर्णन कीजिए।
उत्तर :
गै-लुसैक का नियम (दाब-ताप सम्बन्ध)-स्थिर आयतन पर किसी गैस की निश्चित मात्रा का दाब ताप के प्रत्येक 1°C बढ़ने या घटने पर उसके 0°C वाले दाब का भाग बढ़ या घट जाता है।
यदि किसी गैस की निश्चित मात्रा के ताप 0°C और t°C पर दाब क्रमशः P0तथा Pt हैं तब
जहाँ, k एक स्थिरांक है जिसका मान गैस की मात्रा, उसके आयतन और उस मात्रक पर निर्भर करता है। जिसमें दाब व्यक्त किया गया है।
अत: स्थिर आयतन पर किसी निश्चित मात्रा वाली गैस का दाब उसके परमताप के समानुपाती होता है। इस सम्बन्ध को गै-लुसैक का नियम (Gay-Lussac’s law) कहते हैं।
P= kT से, (जबकि गैस की मात्रा और आयतन स्थिर हैं)
यदि स्थिर आयतन पर गैस के एक नमूने के प्रारम्भिक दाब, प्रारम्भिक परमताप, अन्तिम दाब तथा अन्तिम परमताप क्रमशः P1,T1,P2, तथा T2,हैं तब गै-लुसैक के नियमानुसार, ,
गै-लुसैक के नियम का प्रायोगिक सत्यापन
गै-लुसैक के नियम को संलग्न चित्र में दर्शाए गए उपकरण द्वारा सत्यापित किया जा सकता है। फ्लास्क में ली गई गैस का ताप तापस्थायी (thermostat) द्वारा परिवर्तित किया जा सकता है। तापमापी से गैस का ताप तथा दाबमापी से गैस का दाब ज्ञात करते हैं। प्रत्येक स्थिति में का मान स्थिर (constant) आता है जो गै-लुसैक के नियम का सत्यापन करता है।
गै-लुसैक के नियम का ग्राफीय निरूपण
नियत आयतन वाली किसी गैस की निश्चित मात्रा के दाब तथा परमताप (केल्विन पैमाने पर। ताप) के मध्य ग्राफ एक सीधी रेखा होता है। नीचे की ओर बढ़ाने पर यह सीधी रेखा मूल बिन्दु पर मिलती है जो यह दर्शाता है कि किसी गैस का परम शून्य ताप पर दाब शून्य हो जाता है। दूसरे शब्दों में, परम शून्य ताप पर गैस के अणु गति नहीं करते हैं।
आरेख की प्रत्येक रेखा स्थिर आयतन पर प्राप्त की गयी है अतः इसकी प्रत्येक रेखा सम आयतनी. (isochore) कउत्तराती है।
प्रश्न 4.
द्रव के वाष्प दाब से आप क्या समझते हैं? यह किन-किन कारकों पर निर्भर करता है?
उत्तर :
वाष्प दाब “निश्चित ताप पर यदि कोई द्रव एवं उसकी वाष्प साम्यावस्था में हो, तो वाष्प द्वारा द्रव पर डाला गया दाब, उस द्रव का वाष्प दाब कउत्तराता है।
द्रव ⇌ वाष्प
दिए गए ताप पर द्रव का वाष्प दाब उसका अभिलाक्षणिक गुण है।
द्रव के वाष्प दाब को प्रभावित करने वाले कारक
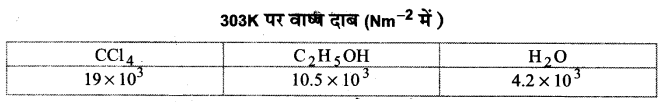
(1) द्रव की प्रकृति-द्रव का वाष्प दाब उसकी प्रकृति पर निर्भर करता है। द्रव के अणुओं के मध्य अन्तरा-अणुक आकर्षण बल का मान उच्च होने पर वाष्प दाब का मान कम होता है क्योंकि द्रव की सतह के अणु शीघ्रता से सतह नही छोड़ते हैं, जबकि अधिक वाष्पशील द्रवों के वाष्प दाब उच्च होते हैं। कार्बन टेट्राक्लोराइड (CCl4), एथिल ऐल्कोहॉल (C2H5OH) तथा जल (H2O) में अन्तराअणुक आकर्षण बल का क्रम कार्बन टेट्राक्लोराइड (CCl4), < एथिल ऐल्कोहॉल (C2H5OH) < जल (H2O) होता है, जबकि इनके वाष्प दाबों के मान का क्रम कार्बन टेट्राक्लोराइड > एथिल ऐल्कोहॉल. > जल होता है।
(2) द्रव का ताप-द्रव को ताप बढ़ाने पर वाष्प दाब के मान में वृद्धि होती है क्योंकि ताप बढ़ाने पर द्रव के अणुओं की गतिज ऊर्जा बढ़ जाती है, फलस्वरूप वाष्पन की दर भी बढ़ जाती है। अतः द्रव का वाष्पीकरण बढ़ जाता है, अर्थात् सतह के अणुओं की द्रव की सतह छोड़ने की प्रवृत्ति बढ़ जाती है। इस कारण वाष्प दाब बढ़ जाता है। वाष्पदाब में ताप के साथ होने वाले परिवर्तन की गणना निम्नलिखित समीकरण द्वारा की जाती है
जहाँ, P1 तथा P2 क्रमशः परम ताप T1 व T2 पर द्रव के वाष्पदाब हैं तथा ∆Hvapan वाष्पीकरण की ऊष्मा है।
(3) अवाष्पशील विलेय का मिलाना-जब विलायक में कोई अवाष्पशील विलेय मिलाते हैं, तो उसका वाष्प दाब घट जाता है क्योंकि द्रव की सतह के कुछ क्षेत्र विलेय के अणु घेर लेते हैं। जिसके कारण द्रव की सतह का क्षेत्रफल कुछ कम हो जाता है, फलस्वरूप वाष्पन कम होता है। वाष्प दाब में होने वाली कमी की गणना राउल्ट के नियम की सहायता से की जाती है। वाष्प दाब का मापन स्थैतिक विधि, गतिक विधि तथा गैस चूंतप्त विधि द्वारा किया जाता है।
प्रश्न 5.
पृष्ठ तनाव से आप क्या समझते हैं। इसे प्रभावित करने वाले कारकै लिखिए?
उत्तर :
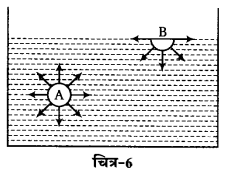
पृष्ठ तनाव-द्रव के अणुओं के मध्य आकर्षण बल होते हैं। द्रव के तले में उपस्थित अणुओं पर लगे शुद्ध आकर्षण बल के कारण ही पृष्ठ तनाव उत्पन्न होता है। माना किं एक बर्तन में द्रव भरा है। इसमें दो द्रव के अणुओं पर विचार करते हैं, अंणु A द्रव के अन्दर है। इसे अणु पर चारों ओर उपस्थित अणुओं के आकर्षण बल लेगेंगे, अतः इस पर लगने वाला शुद्ध आकर्षण बल शून्य हो जाएगा। अणु B द्रव के तल पर स्थित है, अतः इस पर नीचे की ओर एक शुद्ध आकर्षण बल लगेगा, परिणामस्वरूप तल पर एक बल नीचे की ओर लगता है और द्रव के तल का क्षेत्र न्यूनतम होने की कोशिश करेगा द्रव के तल पर लगने वाला वह बल जो उस द्रव के तल का क्षेत्र न्यूनतम रखने की प्रवृत्ति रखता हो, पृष्ठ तनाव कउत्तराता है। माना कि किसी एक द्रव के मुक्त पृष्ठ तल पर रेखा CD खींची जाती हैं जिसकी लम्बाई । तथा उस पृष्ठ के तल में बल F कार्यरत है तो पृष्ठ तनाव ( γ) = F/l होगा। C.G.S. इकाई में यह डाइने प्रति सेमी dyme cm-1) या अर्ग प्रति सेमी (erg cm-1) तथा S.I. इकाई में न्यूटन प्रति मीटर (Nm-1) में व्यक्त किया जाता है। द्रव की बूंद की गोलाकार आकृति, केशनलिका में द्रव्र का चढ़ना या गिरना, द्रव के तल का गोलाकार (उत्तल अथवा अवतल होना) आदि द्रव के पृष्ठ तनाव द्वारा ही समझाए जा सकते हैं; जैसे–ब्यूरेट के जल की सतह अवतल होती है। क्योंकि संसंजक बल का मान आसंजक बल से कम होता है। परन्तु नली में पारे की सतह उत्तल होती है क्योंकि संसंजक बल का मान आसंजक बल से अधिक होता है।
माना कि दो द्रवों के पृष्ठ तनाव γ1 तथा γ2 हैं और एक ही केशनली में दोनों द्रवों के समान आयतन V उपस्थित हैं। केशनली में गिरने वाली द्रव की बूंदों की संख्या n1 और n2 तथा द्रवों के घनत्व n1 और n2 हैं, तो
पृष्ठ तनाव को प्रभावित करने वाले कारक
(1) द्रव का ताप-ताप बढ़ाने पर द्रवों के पृष्ठ तनाव का मान घटता है। क्योकि ताप वृद्धि पर द्रवों के अणुओं की गतिज ऊर्जा के मान में वृद्धि होती है जिसके फलस्वरूप अन्तर-आण्विक आकर्षण बलों के मान घटते हैं। इस कारण पृष्ठ तनाव का मान भी घट जाता है। क्रान्तिक ताप पर जहाँ द्रव एवं वाष्प में विभेद करने वाला तल समा हो जाता है, पृष्ठ तनाव का मान घटकर शून्य हो जाता है।
आटवोस (Eotvos) ने पृष्ठ तनाव को ताप का एक रेखीय फलन (linear function) बताया तथा निम्नलिखित समीकरण दी
जहाँ M→ द्रव पदार्थ का आण्विक द्रव्यमान, D→ द्रव का घनत्व, Tc → क्रान्तिक ताप, T → परम ताप तथा k→ नियतांक है।
(2) द्रव की प्रकृति-पृष्ठ तनाव द्रव की प्रकृति पर निर्भर करता है। द्रवों में अणुओं के मध्य अन्तर-आण्विक बलों के मान बढ़ने पर, पृष्ठ तनाव के मान में वृद्धि होती है। उदाहरणार्थ-ईथर, एथिल ऐल्कोहॉल तथा जल के अणुओं के मध्य अन्तर आण्विक आकर्षण बलों के मान का क्रम ईथर < एथिल ऐल्कोहॉल < जल होता है। इस कारण इनके पृष्ठ तनाव (20°C) के मानों का क्रम ईथर (17.0 डाइन/सेमी) < एथिल ऐल्कोहॉल (22.27 डाइन/सेमी) < जल (72.75 डाइन/सेमी) है। इनके अतिरिक्त ग्लिसरीन, ग्लाइकॉल तथा एथेनॉल में पृष्ठ तनाव का बढ़ता क्रम एथेनॉल < ग्लाइकॉल < ग्लिसरीन होता है।
(3) बाह्य पदार्थों की उपस्थिति–किसी द्रव में पृष्ठ सक्रिय पदार्थ (साबुन/अपमार्जक) मिलाने पर उसका पृष्ठ तनाव कम हो जाता है जबकि आयनिक पदार्थों की उपस्थिति से द्रव का पृष्ठ तनाव बढ़ जाता है। उदाहरणार्थ-जल में साबुन मिलाने पर उसका पृष्ठ तनाव घट जाता है जबकि नमक मिलाने पर जल का पृष्ठ तनाव बढ़ जाता है।
एनसीईआरटी सोलूशन्स क्लास 11 रसायन विज्ञान पीडीएफ
- 1. रसायन विज्ञान की कुछ मूल अवधारणाएं
- 2. परमाणु की संरचना
- 3. तत्वों का वर्गीकरण तथा गुणधर्मो में आवर्तिता
- 4. रासायनिक आबंधन तथा आण्विक संरचना
- 6. ऊष्मागतिकी
- 7. साम्यावस्था
- 8. अपचयोपचय अभिक्रियाएँ
- 9. हाइड्रोजन
- 10. S - ब्लॉक के तत्व
- 11. P - ब्लॉक के तत्व
- 12. कार्बनिक रसायन - कुछ आधारभूत सिद्धांत तथा तकनीकें
- 13. हाइड्रोकार्बन
- 14. पर्यावरणीय रसायन