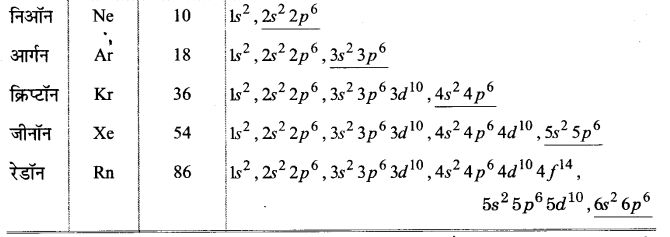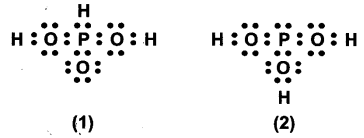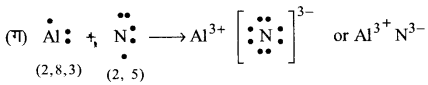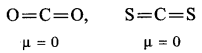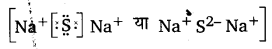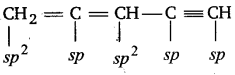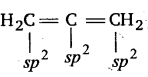NCERT Solutions Class 11 रसायन विज्ञान Chapter-4 (रासायनिक आबन्धन एवं आण्विक संरचना )
Class 11 (रसायन विज्ञान )
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
पाठ-4 (रासायनिक आबन्धन एवं आण्विक संरचना )
अभ्यास के अ न्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
रासायनिक ओबन्ध के बनने की व्याख्या कीजिए।
उत्तर :
द्रव्य’ एक या विभिन्न प्रकार के तत्वों से मिलकर बना होता है। सामान्य स्थितियों में उत्कृष्ट गैसों के अतिरिक्त कोई अन्य तत्व एक स्वतन्त्र परमाणु के रूप में विद्यमान नहीं होता है। परमाणुओं के समूह विशिष्ट गुणों वाली स्पीशीज के रूप में विद्यमान होते हैं। परमाणुओं के ऐसे समूह को ‘अणु’ कहते हैं। प्रत्यक्ष रूप में कोई बल अणुओं के घटक परमाणुओं को आपस में पकड़े रहता है। वस्तुतः रासायनिक आबन्ध को इस प्रकार परिभाषित किया जा सकता हैविभिन्न रासायनिक स्पीशीज में उनके अनेक घटकों (परमाणुओं, आयनों इत्यादि) को संलग्न रखने वाले आकर्षण बल को ‘रासायनिक आबन्ध’ कहते हैं।”
कॉसेल-लूइस अवधारणा के अनुसार, परमाणुओं का संयोजन अर्थात् रासायनिक आबन्ध बनना संयोजी इलेक्ट्रॉनों के एक परमाणु से दूसरे परमाणु पर स्थानान्तरण के द्वारा अथवा संयोजी इलेक्ट्रॉनों के सहभाजन के द्वारा होता है। इस प्रक्रिया में परमाणु अपने संयोजकता कोश में अष्टक प्राप्त करते हैं। जैसे सोडियम क्लोराइड अणु में सोडियम परमाणु अपना एक संयोजी इलेक्ट्रॉन त्याग देता है तथा इस इलेक्ट्रॉन को क्लोरीन परमाणु ग्रहण कर लेता है। इस प्रकार इलेक्ट्रॉनों के स्थानान्तरण के द्वारा दोनों परमाणु अपने-अपने संयोजकता कोश में अष्टेक प्राप्त कर लेते हैं तथा दोनों के मध्य एक रासायनिक आबन्ध (विद्युत-संयोजी आबन्ध) स्थापित हो जाता है।
प्रश्न 2.
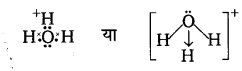
निम्नलिखित तत्वों के परमाणुओं के लूइस बिन्दु प्रतीक लिखिए- Mg, Na, B, 0, N, Br.
उत्तर :
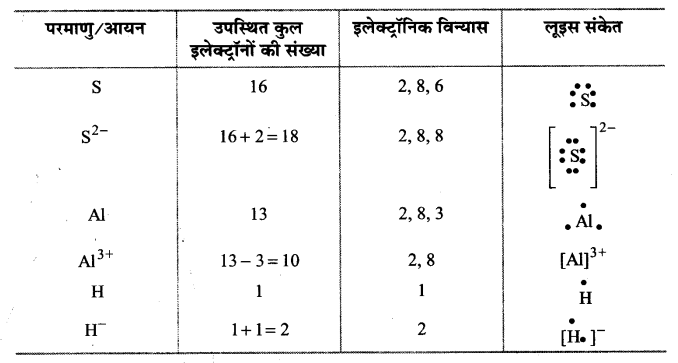
प्रश्न 3.
निम्नलिखित परमाणुओं तथा आयनों के लूइस बिन्दु प्रतीक लिखिए-
S और S2-, AI तथा Al3+, H और H–
उत्तर :
प्रश्न 4.
निम्नलिखित अणुओं तथा आयनों की लूइस संरचनाएँ लिखिए-
H2S, SiCl4, BeF2,CO2-3-, HCOOH
उत्तर :
प्रश्न 5.
अष्टक नियम को परिभाषित कीजिए तथा इस नियम के महत्त्व और सीमाओं को लिखिए।
उत्तर :
अष्टक नियम (Octet Rule)-वर्ग 18 में उपस्थित अक्रिय गैसों अथवा उत्कृष्ट गैस तत्वों • को शून्य वर्ग के तत्व भी कहा जाता है। इसका अर्थ है कि इनकी संयोजकता शून्य है अर्थात् इनके परमाणु स्वतन्त्र अवस्था में पाए जा सकते हैं। उत्कृष्ट गैस तत्वों के इलेक्ट्रॉनिक विन्यास निम्नांकित सारणी में दिए गए हैं-
प्रथम सदस्य हीलियम, जिसके संयोजी कोश में केवल दो इलेक्ट्रॉन हैं, के अतिरिक्त शेष सदस्यों के संयोजी कोश में आठ इलेक्ट्रॉन हैं। सन् 1916 में जी०एन० लूइस तथा कॉसेल ने ज्ञात किया कि उत्कृष्ट गैस तत्वों का स्थायित्व इनके संयोजी कोशों में आठ इलेक्ट्रॉनों (हीलियम को छोड़कर) अथवा पूर्ण अष्टक की उपस्थिति के कारण होता है। इनके अनुसार अन्य तत्वों के परमाणुओं के बाह्य कोश में आठ से कम इलेक्ट्रॉन होते हैं; अतः ये तत्व अपना आदर्श स्थायी रूप प्राप्त करने के प्रयत्न में रासायनिक संयोजनों में भाग लेते हैं जिससे वे इलेक्ट्रॉनों के आदान-प्रदान द्वारा अपने समीपवर्ती अक्रिय गैस के समान इलेक्ट्रॉनिक विन्यास ग्रहण कर सकें। इसे अष्टक नियम कहते हैं। वास्तव में इलेक्ट्रॉनों द्वारा रासायनिक आबन्धों के बनने की व्याख्या के लिए कई प्रयास किए गए, परन्तु कॉसेल तथा लुइस स्वतन्त्र रूप से सन्तोषजनक व्याख्या देने में सफल हुए। उन्होंने सर्वप्रथम संयोजकता की तर्क-संगत व्याख्या की। यह व्याख्या उपर्युक्त दी गई उत्कृष्ट गैसों की अक्रियता पर आधारित थी।
लूइस परमाणुओं को एक धन-आवेशित अष्टि (नाभिक तथा आन्तरिक इलेक्ट्रॉन युक्त) तथा बाह्य कक्षकों के रूप में निरूपित किया गया। बाह्य कक्षकों में अधिकतम आठ इलेक्ट्रॉन समाहित हो सकते हैं। उसने यह माना कि ये आठों इलेक्ट्रॉन घन के आठ कोनों पर उपस्थित हैं, जो केन्द्रीय अष्टि को चारों ओर से घेरे रहते हैं। इस प्रकार सोडियम के बाह्य कोश में उपस्थित एकल इलेक्ट्रॉन घन के एक कोने पर स्थित रहता है, जबकि उत्कृष्ट गैसों में घन के आठों कोनों पर एक-एक इलेक्ट्रॉन उपस्थित रहते हैं। लूइस ने यह अभिगृहीत दिया कि परमाणु परस्पर रासायनिक आबन्ध द्वारा संयुक्त होकर अपने स्थायी अष्टक को प्राप्त करते हैं। उदाहरण के लिए सोडियम एवं क्लोरीन में सोडियम अपने एक इलेक्ट्रॉन को क्लोरीन को सरलतापूर्वक देकर अपना स्थायी अष्टक प्राप्त करता है तथा क्लोरीन एक इलेक्ट्रॉन प्राप्त कर अपना स्थायी अष्टक निर्मित करता है, अर्थात् सोडियम (Na+) तथा क्लोरीन (Cl–) आयन बनते हैं।
Na → Na+ +e–
Cl + e → Cl
Na+ +Cl– → NaCl या Na+ Cl–
इस प्रकार कॉसेल तथा लूइस ने परमाणुओं के बीच रासायनिक संयोजन के एक महत्त्वपूर्ण सिद्धान्त को विकसित किया। इसे ‘रासायनिक आबन्धन का इलेक्ट्रॉनिकी सिद्धान्त’ कहा जाता है। इस सिद्धान्त के अनुसार-
परमाणुओं का संयोजन संयोजक इलेक्ट्रॉनों के एक परमाणु से दूसरे परमाणु पर स्थानान्तरण के द्वारा अथवा संयोजक इलेक्ट्रॉनों के सहभाजन (sharing) के द्वारा होता है।”
इस प्रक्रिया में परमाणु अपने संयोजकता कोश में अष्टक प्राप्त करते हैं।
अष्टक नियम का महत्त्व (Significance of Octet Rule)
अष्टक नियम अत्यन्त उपयोगी है। इसका महत्त्व निम्नवर्णित है-
- अधिकांश अणु अष्टक नियम का अनुसरण करके ही निर्मित होते हैं; जैसे—O2, N2, Cl2, Br2, आदि।
- अधिकांश कार्बनिक यौगिकों की संरचनाओं को समझने में अष्टक नियम का अत्यधिक महत्त्व है।
- इसे मुख्य रूप से आवर्त सारणी के द्वितीय आवर्त के तत्वों पर लागू किया जा सकता है।
अष्टक नियम की सीमाएँ (Limitations of Octet Rule) यद्यपि अष्टक नियम अत्यन्त उपयोगी है, परन्तु यह सदैव लागू नहीं किया जा सकता अर्थात् यह सार्वत्रिक (universal) नहीं है। अष्टक नियम के तीन प्रमुख अपवाद निम्नलिखित हैं-
(1) केन्द्रीय परमाणु का अपूर्ण अष्टक (Incomplete octet of central atom)-कुछ यौगिकों में केन्द्रीय परमाणु के चारों ओर उपस्थित इलेक्ट्रॉनों की संख्या आठ से कम होती है। यह मुख्यत: उन तत्वों के यौगिकों में होता है जिनमें संयोजकता इलेक्ट्रॉनों की संख्या चार से कम होती है। उदाहरण के लिएLiCl2BeH2 तथा BCl3 के बनने में,
Li, Be तथा B के संयोजकता इलेक्ट्रॉनों की संख्या क्रमशः 1, 2 तथा 3 हैं। इस प्रकार के अन्य उदाहरण AICl3 तथा BF;हैं।
(2) विषम इलेक्ट्रॉन अणु (Odd electron molecule)–उन अणुओं, जिनमें इलेक्ट्रॉनों की कुल संख्या विषम (odd) होती है; जैसे-नाइट्रिक ऑक्साइड (NO) तथा नाइट्रोजन डाइऑक्साइड (NO2) में सभी परमाणु अष्टक नियम का पालन नहीं कर पाते।
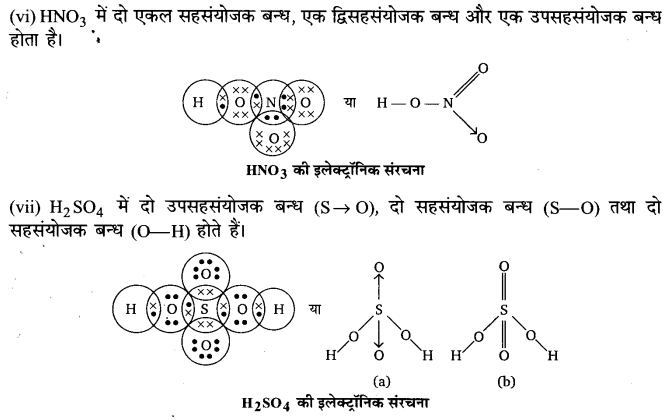
(3) प्रसारित अष्टक (Expanded octet):-आवर्त सारणी के तीसरे तथा इससे आगे के आवर्ती के तत्वों में आबन्धन के लिए 35 तथा 3p-कक्षकों के अतिरिक्त 3d-कक्षक भी उपलब्ध होते हैं। इन तत्वों के अनेक यौगिकों में केन्द्रीय परमाणु के चारों ओर आठ से अधिक इलेक्ट्रॉन होते हैं। इसे प्रसन्नरत अष्टक (expanded octet) कहते हैं। स्पष्ट है कि इन यौगिकों पर अष्टक नियम लागू नहीं होता है। ऐसे यौगिकों के कुछ उदाहरण हैंPFs, SF 6, H2SO4 तथा कई उपसहसंयोजक यौगिक।
प्रश्न 6.
आयनिक आबन्ध बनाने के लिए अनुकूल कारकों को लिखिए।
उत्तर :
आयनिक आबन्ध बनाने के लिए अनुकूल कारक (Favourable Factors for lonic Bond formation) आयनिक आबन्ध बनाने के लिए निम्नलिखित कारक अनुकूल होते हैं
(1) आयनन एन्थैल्पी (Ionization enthalpy)–धनात्मक आयन या धनायन के बनने में किसी एक परमाणु को इलेक्ट्रॉनों का त्याग करना पड़ता है जिसके लिए आयनन एन्थैल्पी की आवश्यकता होती है। हम जानते हैं कि आयनन एन्थैल्पी ऊर्जा की वह मात्रा है जो किसी विलगित गैसीय परमाणु से बाह्यतम इलेक्ट्रॉन निकालने के लिए आवश्यक होती है; अत: आयनन एन्थैल्पी की जितनी कम आवश्यकता होगी, धनायन का निर्माण उतना ही सरल होगा। 5-ब्लॉक में उपस्थित क्षार धातुएँ एवं क्षारीय मृदा धातुएँ सामान्यत: धनायन बनाती हैं; क्योंकि इनकी आयनन एन्थैल्पी अपेक्षाकृत कम होती
(2) इलेक्ट्रॉन लब्धि एन्थैल्पी (Electron gain enthalpy)–धनायनों के निर्माण में मुक्त हुए। इलेक्ट्रॉन, आयनिक बन्ध के निर्माण में भाग ले रहे अन्य परमाणु द्वारा ग्रहण कर लिए जाते हैं। परमाणुओं की इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति इलेक्ट्रॉन लब्धि एन्थैल्पी पर निर्भर करती है। किसी विलगित गैसीय परमाणु द्वारा एक इलेक्ट्रॉन ग्रहण करके ऋणायन बनने में जितनी ऊर्जा विमुक्त होती है, इलेक्ट्रॉन लब्धि एन्थैल्पी कहलाती है। इस प्रकार स्पष्ट है कि इलेक्ट्रॉन लब्धि एन्थैल्पी के अधिक ऋणात्मक होने पर ऋणायन का निर्माण सरल होगा। वर्ग 17 में उपस्थित हैलोजेनों की ऋणायन बनाने की प्रवृत्ति सर्वाधिक होती है, क्योंकि इनकी इलेक्ट्रॉन लब्धि एन्थैल्पी अत्यन्त उच्च ऋणात्मक होती है। ऑक्सीजन परिवार (वर्ग 16) के सदस्यों में भी ऋणायन बनाने की प्रवृत्ति होती है, परन्तु अधिक सरलता से यह सम्भव नहीं होता; क्योंकि ऊर्जा की आवश्यकता द्विसंयोजी ऋणायन (O2-) बनाने के लिए होती है।
(3) जालक ऊर्जा या एन्थैल्पी (Lattice energy or enthalpy)–आयनिक यौगिक क्रिस्टलीय ठोसों के रूप में होते हैं तथा आयनिक यौगिकों के क्रिस्टलों में धनायन तथा ऋणायन त्रिविमीय रूप में नियमित रूप से व्यवस्थित रहते हैं। चूंकि आयन आवेशित स्पीशीज हैं; अत: आयनों के आकर्षण में विमुक्त ऊर्जा जालक ऊर्जा या एन्थैल्पी कहलाती है। इसे इस प्रकार परिभाषित किया जा सकता है– विपरीत, आवेश वाले आयनों के संयोजन द्वारा जब क्रिस्टलीय ठोस का एक मोल प्राप्त होता है, तब विमुक्त ऊर्जा जालक ऊर्जा या एन्थैल्पी कहलाती है।”
इसे ‘U’ द्वारा व्यक्त किया जाता है।
A+(g)+ B– (g) A+B– (s)+ जालक ऊर्जा (U)
इस प्रकार स्पष्ट है कि जालक ऊर्जा का परिमाण अक्कि होने पर आयनिक बन्ध अथवा आयनिक यौगिक का स्थायित्व अधिक होगा।
निष्कर्षत: यदि जालक ऊर्जा का परिमाण तथा ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी आवश्यक आयनन एन्थैल्पी की तुलना में अधिक होंगे, तब एक स्थायी रासायनिक बन्ध प्राप्त होगा। इनके कम होने पर बन्ध का विरचन नहीं होगा।
प्रश्न 7.
निम्नलिखित अणुओं की आकृति की व्याख्या ‘वी०एसईपी०आर० सिद्धान्त के अनुरूप कीजिए-
BeCl2, BCl3, SiCl4, AsF5, H2S, PH3
उत्तर :
BeCl2 : केन्द्रीय Be परमाणु में केवल 2 आबन्धः युग्म हैं तथा कोई एकाकी युग्म नहीं (Cl: Be :C) है। अत: इसकी आकृति रेखीय (linear) होगी।
BCl3 : केन्द्रीय बोरोन परमाणु में केवल 3 बन्ध युग्म हैं तथा कोई एकाकी युग्म नहीं
SiCl4 : केन्द्रीय सिलिकॉन परमाणु में 4 आबन्ध युग्म हैं तथा कोई एकाकी युग्म नहीं
SiCl4 : केन्द्रीय ऑसेनिक परमाणु में 5 आबन्ध युग्म हैं तथा कोई एकाकी युग्म नहीं
 है। अत: इसकी आकृति त्रिभुजाकार द्विपिरामिडीय है।
है। अत: इसकी आकृति त्रिभुजाकार द्विपिरामिडीय है।
H2S: केन्द्रीय सल्फर परमाणु में 2 आबन्ध युग्म हैं तथा कोई एकाकी युग्म नहीं  है। अतः इसकी आकृति बंकित (bent) होगी।
है। अतः इसकी आकृति बंकित (bent) होगी।
PH3 : केन्द्रीय फॉस्फोरस परमाणु में 3 आबन्ध युग्म हैं और एक एकाकी युग्म  है। अत: इसकी आकृति त्रिकोणीय समतलीय (trigonal planar) होगी।
है। अत: इसकी आकृति त्रिकोणीय समतलीय (trigonal planar) होगी।
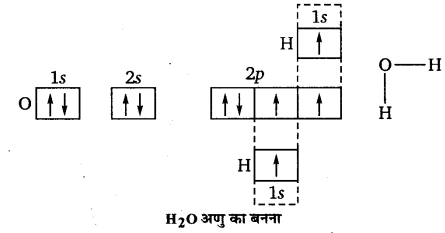
प्रश्न 8.
यद्यपि NH3 तथा H2O दोनों अणुओं की ज्यामिति विकृत चतुष्फलकीय होती है, तथापि जल में आबन्ध कोण अमोनिया की अपेक्षा कम होता है। विवेचना कीजिए।
उत्तर :
NH3 अणु में नाइट्रोजन परमाणु पर एक एकाकी इलेक्ट्रॉन युग्म, जबकि H2O अणु में ऑक्सीजन परमाणु पर दो एकाकी इलेक्ट्रॉन युग्म उपस्थित हैं। VSEPR सिद्धान्त के अनुसार, हम जानते हैं कि इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण अन्योन्यक्रियाएँ निम्नलिखित क्रम में घटती हैं-
एकाकी युग्म-एकाकी युग्म > एकाकी युग्म-आबन्धी युग्म > आबन्धी युग्म-आबन्धी युग्म
या lp-lp> lp-bp> bp – bp
ऑक्सीजन परमाणु के पास अधिकं एकाकी इलेक्ट्रॉन युग्म होने के कारण H2O में O—H आबन्ध-युग्म, NH3 में N—H आबन्ध युग्मों की अपेक्षा अधिक निकट होते हैं; अत: NH3 में आबन्ध कोण (107°) H2O के आबन्ध कोण (104:5°) से अधिक होता है।
प्रश्न 9.
आबन्ध प्रबलता को आबन्ध कोटि के रूप में आप किस प्रकार व्यक्त करेंगे?
उत्तर :
यदि आबन्ध विघटन एन्थैल्पी (bond dissociation enthalpy) अधिक है तो आबन्ध अधिक प्रबल होगा तथा आबन्ध कोटि बढ़ने पर आबन्ध एन्थैल्पी बढ़ती है। इस तथ्य से स्पष्ट हैं कि आबन्ध प्रबलता तथा आबन्ध कोटि परस्पर समानुपाती होते हैं। अत: आबन्ध कोटि बढ़ने पर, आबन्ध प्रबलता भी अधिक होगी। उदाहरणार्थ-N2 की आबन्ध कोटि 3 है तथा इसकी आबन्ध एन्थैल्पी 945 kJ mol-1 है। इसी प्रकार O2 की आबन्ध कोटि 2 है तथा इसकी आबन्ध एन्थैल्पी 945 kJ mol-1 है। इनमें N, आबन्ध अधिक प्रबल होगा।
प्रश्न 10.
आबन्ध-लम्बाई की परिभाषा दीजिए।
उत्तर :
किसी अणु में आबन्धित परमाणुओं के नाभिकों के बीच साम्यावस्था दूरी आबन्ध-लम्बाई कहलाती है। आबन्ध-लम्बाई के मान सामान्यत: पिकोमीटर (1 pm= 10-12 m) में व्यक्त किए जाते है।
आयनिक यौगिकों में दो आबन्धित परमाणुओं के मध्य आबन्ध-लम्बाई उनकी आयनिक त्रिज्याओं को जोड़कर प्राप्त की जाती है। इसी प्रकार सहसंयोजी यौगिकों में दो आबन्धित परमाणुओं के मध्य आबन्ध-लम्बाई उनकी सहसंयोजी (परमाणु) त्रिज्या जोड़कर प्राप्त की जाती है।
प्रश्न 11.
Co2-3 आयन के सन्दर्भ में अनुनाद के विभिन्न पहलुओं को स्पष्ट कीजिए।
उत्तर :
कार्बन तथा ऑक्सीजन परमाणुओं के मध्य दो एकल आबन्ध तथा एक द्वि-आबन्ध वाली लूइस संरचना कार्बोनेट आयन की वास्तविक संरचना को निरूपित करने के लिए अपर्याप्त है; क्योंकि इसके अनुसार तीन कार्बन-ऑक्सीजन आबन्धों की लम्बाई भिन्न होनी चाहिए। परन्तु प्रायोगिक परिणामों के अनुसार कार्बोनेट आयन के तीनों कार्बन-ऑक्सीजन आबन्धों की लम्बाई समान होती है। अत: कार्बोनेट आयन की वास्तविक संरचना को निम्नलिखित तीन विहित संरचनाओं (I, II तथा III) के अनुनाद संकर के रूप में दर्शाया जा सकता है-
प्रश्न 12.
नीचे दी गई संरचनाओं (1 तथा 2) द्वारा H3PO3 को प्रदर्शित किया जा सकता है। क्या ये दो संरचनाएँ H3PO3 के अनुनाद संकर के विहित (केनॉनीकल) रूप माने जा सकते हैं? यदि नहीं तो उसका कारण बताइए।
उत्तर :
दी गई संरचनाओं (1) तथा (2) में हाइड्रोजन परमाणु की स्थिति समान नहीं है। परमाणुओं की स्थिति में परिवर्तन होने के कारण, ये H3PO3 के अनुनाद संकर के विदित (केनॉनीकल) रूप नहीं माने जा सकते हैं।
प्रश्न 13.
SO3, NO2, तथा NO–3s की अनुनाद संरचनाएँ लिखिए।
उत्तर :
प्रश्न 14.
निम्नलिखित परमाणुओं से इलेक्ट्रॉन स्थानान्तरण द्वारा धनायनों तथा ऋणायनों में विरचन को लूइस बिन्दु-प्रतीकों की सहायता से दर्शाइए-
(क) K तथा S
(ख) Ca तथा O
(ग) Al तथा N
उत्तर :
प्रश्न 15.
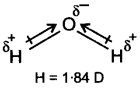
हालाँकि CO2 तथा H2O दोनों त्रिपरमाणुक अणु हैं, परन्तु H2O अणु की आकृति बंकित होती है, जबकि CO2 की रैखिक आकृति होती है। द्विध्रुव आघूर्ण के आधार पर इसकी व्याख्या कीजिए।
उत्तर :
H2O अणु-H2O अणु का द्विध्रुव आघूर्ण 1.84D होता है। H2O अणु में दो OH आबन्ध होते हैं। ये O—H आबन्ध ध्रुवी होते हैं तथा इनका द्विध्रुव आघूर्ण 1.5 D होता है। चूंकि जल-अणु में परिणामी द्विध्रुव होता है; अत: दोनों OH-द्विध्रुव एक सरल रेखा में नहीं होंगे तथा एक-दूसरे को समाप्त नहीं करेंगे। इस प्रकार H2O अणु की रैखिक संरचना नहीं होती। H2O अणु में O—H आबन्ध परस्पर एक निश्चित कोण पर स्थित होते हैं अर्थात् H,0 अणु की कोणीय संरचना होती है।
CO2अणु CO2अणु का द्विध्रुव आघूर्ण शून्य होता है। CO2 अणु में दो C=O आबन्ध होते हैं। प्रत्येक C=O आबन्ध एक ध्रुवी आबन्ध है। इसका अर्थ है कि प्रत्येक आबन्ध में द्विध्रुव आघूर्ण होता है। चूंकि CO2अणु का परिणामी द्विध्रुव आघूर्ण शून्य होता है; अतः दोनों आबन्ध द्विध्रुव अर्थात् दोनों आबन्ध एक-दूसरे के विपरीत होने चाहिए अर्थात् दोनों आबन्ध :एक-दूसरे से 180° पर स्थित होने चाहिए। इस प्रकार स्पष्ट है कि CO2 अणु की संरचना रैखिके होती है।
प्रश्न 16.
द्विध्रुव आघूर्ण के महत्त्वपूर्ण अनुप्रयोग बताइए।
उत्तर :
द्विध्रुव आघूर्ण के महत्त्वपूर्ण अनुप्रयोग (Important Applications of Dipole Moment) द्विध्रुव-आघूर्ण के कुछ महत्त्वपूर्ण अनुप्रयोग निम्नलिखित हैं-
(1) अणुओं की प्रकृति ज्ञात करना (Predicting the nature of the molecules)–एक निश्चित द्विध्रुव आघूर्ण वाले अणु प्रकृति में ध्रुवी होते हैं, जबकि शून्य द्विध्रुव आघूर्ण वाले अणु अध्रुवी होते हैं। अत: BeF2 (μ = 0 D) अध्रुवी है, जबकि H2O (μ = 1.84 D) ध्रुवी होता है।
(2) अणुओं की आण्विक संरचना ज्ञात करना (Predicting the molecular structure of the molecules)-हम जानते हैं कि परमाणुक गैसें; जैसे–अक्रिय गैसों आदि का द्विध्रुव आघूर्ण शून्य होता है, अर्थात् ये अधूवी हैं, परन्तु द्वि-परमाणुक अणु ध्रुवीय तथा अध्रुवीय होते हैं; जैसे-H2O2 आदि अध्रुवी हैं (u = 0) तथा CO ध्रुवीय है। इन अणुओं की संरचना भी रैखिक होती है।
त्रिपरमाणुक अणु भी ध्रुवीय तथा अध्रुवीय होते हैं। CO2, CS2,आदि अध्रुवी होते हैं; क्योंकि इनके लिए μ = 0 होते हैं; अत: इन अणुओं की संरचना रैखिक होती है जिनको निम्नांकित प्रकार से प्रदर्शित कर सकते हैं-
जल अणु ध्रुवी है, क्योंकि μ = 184 D होता है; अत: इसकी संरचना रैखिक नहीं हो सकती है। इसकी कोणीय संरचना होती है तथा प्रत्येक O—H बन्ध के मध्य 104°5′ का कोण होता है। इसी प्रकार H2S व SO2की भी कोणीय संरचनाएँ हैं; क्योंकि इनके लिए के मान क्रमशः 0.90 D व 1.71 D हैं।।
चार परमाणुकता वाले अणु भी ध्रुवीय तथा अध्रुवीय होते हैं। BCl3 अणु के लिए μ = 0 होता है अर्थात् अध्रुवीय होता है। अतः इसकी संरचना समद्विबाहु त्रिभुज के समान होती है।
(3) आबन्धों की धुवणता ज्ञात करना (Determining the polarity of the bonds)– सहसंयोजी आबन्धयुक्त यौगिक में आयनिक गुण या ध्रुवणता उस बन्ध के निर्माण में प्रयुक्त तत्वों के परमाणुओं की विद्युत-ऋणात्मकता पर निर्भर करता है। इस प्रकार, आबन्ध की ध्रुवणता ∝ आबन्ध के परमाणुओं की विद्युत-ऋणात्मकता में अन्तर तथा द्विध्रुव आघूर्ण ∝ आबन्ध के परमाणुओं की विद्युत-ऋणात्मकता में अन्तर
∴ आबन्ध की ध्रुवणता ∝ द्विध्रुव आघूर्ण (μ)
उदाहरणार्थ-HE, HCI, HBr व HI के द्विध्रुव आघूर्ण क्रमशः 1.94D, 1.03 D, 0.68D व 0.34D हैं; क्योंकि इनमें हैलोजेन की विद्युत-ऋणात्मकता का क्रम F > Cl> Br> I है। अतः आबन्धों में विद्युत-ऋणात्मकता अन्तर H—F > H-Cl> H-Br> H-I है। इससे प्रकट होता है कि इन आबन्धों की ध्रुवणता फ्लुओरीन से आयोडीन की ओर चलने से घटती है।
(4) आबन्धों में आयनिक प्रतिशतता ज्ञात करना (Determining the ionic percentage of the bonds)–द्विध्रुव आघूर्ण मान, ध्रुवी आबन्धों की आयनिक प्रतिशतता ज्ञात करने में सहायता प्रदान करते हैं। यह प्रेक्षित द्विध्रुव आघूर्ण अथवा प्रायोगिक रूप से निर्धारित द्विध्रुव आघूर्ण से सम्पूर्ण इलेक्ट्रॉन-स्थानान्तरण के द्विध्रुव आघूर्ण (सैद्धान्तिक) का अनुपात होता है। उदाहरणार्थ-HCl अणु का प्रेक्षित द्विध्रुव आघूर्ण 1.04 D है। यदि H—Cl आबन्ध में इलेक्ट्रॉन युग्म एक ओर हो तो इसका द्विध्रुव आघूर्ण (सैद्धान्तिक) q x d के सूत्र से ज्ञात किया जा सकता है। q का मान 4.808×10-10esu तथा H व Cl के मध्य बन्ध-लम्बाई 1.266 x 10-8 cm पाई गई है।
अतः H व Ci के बीच सहसंयोजक आबन्ध 17.1% विद्युत संयोजक है अर्थात् आयनिक है।
प्रश्न 17.
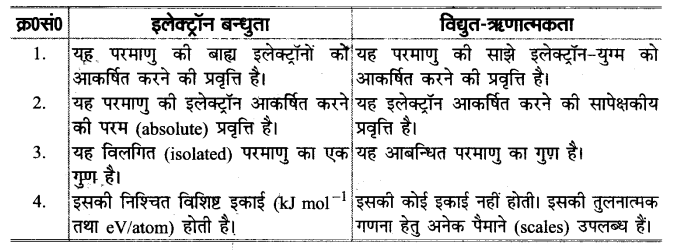
विद्युत-ऋणात्मकता की परिभाषित कीजिए। यह इलेक्ट्रॉन बन्धुता से किस प्रकार भिन्न है?
उत्तर :
विद्युत-ऋणात्मकता (Electronegativity)-किसी तत्व की विद्युत-ऋणात्मकता को इस प्रकार परिभाषित किया जा सकता है कि इसके परमाणु की सहसंयोजक आबन्ध में साझे के इलेक्ट्रॉन-युग्म को अपनी ओर आकर्षित करने की प्रवृत्ति की माप, तत्व की विद्युत-ऋणात्मकता कहलाती है।
विद्युत-ऋणात्मकता तथा इलेक्ट्रॉन-लब्धि एन्थैल्पी या इलेक्ट्रॉन बन्धुता में अन्तर निम्नलिखित हैं-
प्रश्न 18.
ध्रुवीय सहसंयोजी आंबन्ध से आप क्या समझते हैं? उदाहरण सहित व्याख्या कीजिए।
उत्तर :
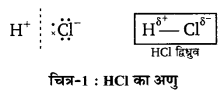
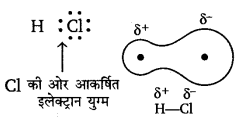
ध्रुवीय सहसंयोजी यौगिक (Polar covalent compound)—बहुत-से अणुओं में एक परमाणु दूसरे परमाणु से अधिक ऋण-विद्युतीय होता है तो इसकी प्रवृत्ति सहसंयोजी बन्ध के इलेक्ट्रॉन युग्म को अपनी ओर खींचने की होती है, इसलिए वह इलेक्ट्रॉन युग्म सही रूप से अणु के केन्द्र में नहीं रहता है, बल्कि अधिक ऋण विद्युती तत्व के परमाणु की ओर आकर्षित रहता है। इस कारण एक . परमाणु पर धन आवेश (जिसकी ऋण-विद्युतीयता कम है) तथा दूसरे परमाणु पर ऋण आवेश (जिसकी ऋण-विद्युतीयता अधिक होती है) उत्पन्न हो जाता है। इस प्रकार प्राप्त अणु ध्रुवीय सहसंयोजी यौगिक कहलाता है और उसमें उत्पन्न बन्ध ध्रुवीय सहसंयोजी आबन्ध कहलाता है।
उदाहरण-HCl अणु का बनना—क्लोरीन की विद्युत-ऋणात्मकता हाइड्रोजन की अपेक्षा अधिक है; अत: साझे का इलेक्ट्रॉन युग्म CI परमाणु के अत्यन्त निकट होता है। फलस्वरूप H पर धन आवेश तथा Cl पर ऋण आवेश आ जाता है तथा HCl ध्रुवीय यौगिक की भाँति कार्य करने लगता है; अत: यह ध्रुवीय सहसंयोजी यौगिक का उदाहरण है।
प्रश्न 19.
निम्नलिखित अणुओं को आबन्धों की बढ़ती आयनिक प्रकृति के क्रम में लिखिए-
LiF, K20, N2, SO2) तथा ClF2.
उत्तर :
सामान्यतः, संयोग करने वाले परमाणुओं की विद्युत ऋणात्मकताओं में जितना अधिक अन्तर होगा, अणु में उतने ही अधिक आयनिक लक्षण होंगे। अणु की आकृति भी इस सम्बन्ध में महत्त्वपूर्ण है। दिये गये अणुओं का आयनिक प्रकृति के आधार पर क्रम निम्न है-
N2 <SO2 <ClF2 <F2O
ClF3 का SO2 की तुलना में अधिक आयनिक होना इसकी T-आकृति के कारण है।
प्रश्न 20.
CH3COOH की नीचे दी गई ढाँचा-संरचना सही है, परन्तु कुछ आबन्ध त्रुटिपूर्ण दर्शाए गए हैं। ऐसीटिक अम्ल की सही लूइस-संरचना लिखिए-
उत्तर :
सही लुइस संरचना निम्न है-
प्रश्न 21.
चतुष्फलकीय ज्यामिति के अलावा CH4 अणु की एक और सम्भव ज्यामिति वर्ग-समतली है जिसमें हाइड्रोजन के चार परमाणु एक वर्ग के चार कोनों पर होते हैं। व्याख्या कीजिए कि CH4 का अणु वर्ग-समतली नहीं होता है।
उत्तर :
वर्ग-समतली ज्यामिति के लिए, dsp2 संकरण आवश्यक है। कार्बन परमाणु को उत्तेजित अवस्था में विन्यास 1s2 2s2 2p1x 2p1y, 2p1z है। इसके पास 4-कक्षक नहीं है। अत: यह dsp2 संकरण में भाग नहीं ले सकता। इस कारण CH4 की वर्ग–समतली आकृति सम्भव नहीं है। CH4 में, कार्बन परमाणु sp3 संकरित अवस्था में होता है जो CH4 के अणु को आकृति में चतुष्फलकीय (tetrahedral) बनाता है।
प्रश्न 22.
यद्यपि Be-H आबन्ध ध्रुवीय है, तथापि BeH, अणु का द्विध्रुव आघूर्ण शून्य है। स्पष्ट कीजिए।
उत्तर :
sp संकरण के कारण BeH2अणु की ज्यामिति रेखीय होती है। इस कारण इसमें उपस्थित दोनों BeH आबन्धों के आबन्ध आघूर्ण (bond moments) एक-दूसरे के विपरीत दिशा में कार्य करते हैं। परिणाम में समान होने के कारण तथा विपरीत दिशा में कार्य करने के कारण ये एक-दूसरे का निराकरण कर देते हैं। फलस्वरूप BeH2का द्विध्रुव आघूर्ण शून्य प्राप्त होता है।
प्रश्न 23.
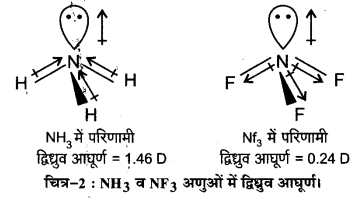
NH3 तथा NF3 में किस अणु का द्विध्रुव आघूर्ण अधिक है और क्यों?
उत्तर :
NH3 तथा NF3, दोनों अणुओं की पिरामिडी आकृति होती है तथा दोनों NH3 (3.0-2.1 = (0.9) तथा NF3 (4.0-3.0 = 1.0) अणुओं में विद्युत-ऋणात्मकता अन्तर भी लगभग समान होता है, परन्तु NH3 का द्विध्रुव आघूर्ण (1.46 D), NF3 (0.24 D) की तुलना में अधिक होता है।
इसकी व्याख्या द्विध्रुव आघूर्णो की दिशा में अन्तर के आधार पर की जा सकती है। NH3 में नाइट्रोजन परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन-युग्म का कक्षक द्विध्रुव आघूर्ण तीन N—F आबन्धों के द्विध्रुव आघूर्गों के परिणामी द्विध्रुव आघूर्ण की विपरीत दिशा में होता है। कक्षक द्विध्रुव आघूर्ण एकाकी इलेक्ट्रॉन-युग्मं के कारण N—F आबन्ध-आघूर्गों के परिणामी द्विध्रुव आधूर्ण के प्रभाव को कम करता है। इसके फलस्वरूप NH3 के अणु का द्विध्रुव आघूर्ण कम होता है।
प्रश्न 24.
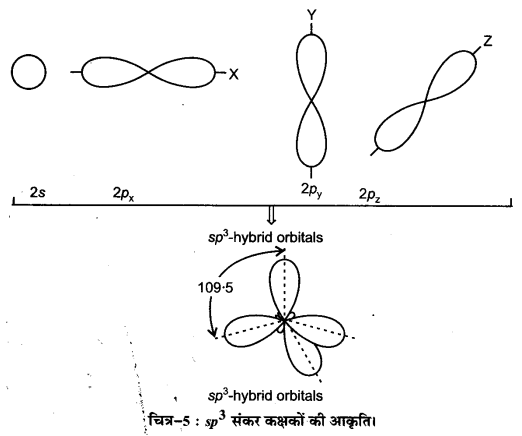
परमाणु कक्षकों के संकरण से आप क्या समझते हैं। sp, sp2 तथा sp3 संकर कक्षकों की आकृति का वर्णन कीजिए।
उत्तर :
संकरण (Hybridisation)-CH4, NH5, H2O जैसे बहुपरमाणुक अणुओं की विशिष्ट ज्यामितीय आकृतियों को स्पष्ट करने के लिए पॉलिंग ने परमाणु कक्षकों के सिद्धान्त को प्रतिपादित किया। पॉलिंग के अनुसार परमाणु कक्षक संयोजित होकर समतुल्य कक्षकों का समूह बनाते हैं। इन कक्षकों को संकर कक्षक कहते हैं। आबन्ध विरचन में परमाणु शुद्ध कक्षकों के स्थान पर संकरित कक्षकों का प्रयोग करते हैं। इस परिघटना को हम संकरण कहते हैं। इसे निम्नवत् परिभाषित किया जा सकता है
“लगभग समान ऊर्जा वाले कक्षकों के आपस में मिलकर ऊर्जा के पुनर्वितरण द्वारा समान ऊर्जा तथा आकार वाले कक्षकों को बनाने की प्रक्रिया को संकरण कहते हैं।”
उदाहरणार्थ-कार्बन का एक 2s कक्षक तथा तीन 2p कक्षक संकरण द्वारा चार नए sp3 संकर कक्षक बनाते हैं।
sp, sp2 तथा sp3 संकर कक्षकों की आकृति (Shapes of sp, sp2 and sp3 hybrid orbitals)
sp, sp2 तथा sp3 संकर कक्षकों की आकृति का वर्णन निम्नलिखित है–
(i) sp संकर कक्षक (sp-hybridised orbitals)-sp संकरण में परमाणु की संयोजकता कोश के -उपकोश का एक कक्षक तथा p-उपकोश का एक कक्षक मिलकर समान आकृति एवं तुल्य ऊर्जा के sp संकरित कक्षक बनाते हैं। ये कक्षक आकृति में 180° के कोण पर अभिविन्यसित होते हैं।
(ii) sp2 संकरे कक्षक (sp2-hybridised orbitals)-sp2– संकरण में परमाणु की संयोजकता कोश के 5-उपकोश का एक कक्षक तथा p-उपकोश के दो कक्षक संयोजित होकर समान आकृति एवं तुल्य ऊर्जा के sp2 संकर कक्षक बनाते हैं। ये sp2 संकर कक्षक एक तल में स्थित होते हैं तथा एक समबाहु त्रिभुज के कोनों पर एवं 120° कोण पर निर्देशित रहते हैं।
(iii) sp3 संकर कक्षक (sp3-hybridised orbitals)-sp3 संकरण में परमाणु की संयोजकता कोश के -उपकोश, का एक कक्षक तथा p-उपकोश के तीन कक्षक संयोजित होकर समान आकृति एवं तुल्य ऊर्जा के चार sp3 संकर कक्षक बनाते हैं। ये चारों sp3 संकर कक्षक एक चतुष्फलक के चारों कोनों पर निर्देशित रहते हैं।
प्रश्न 25.
निम्नलिखित अभिक्रिया में Al परमाणु की संकरण अवस्था में परिवर्तन (यदि होता है तो) को समझाइए-
AlCl3 + Cl– > AlCl–4
उत्तर :
AlCl3,का निर्माण, केन्द्रीय Al परमाणु के sp2 संकरण के द्वारा होता है। (Al: 1s2 2s2 2p6 3s1 3p1x 3p1–) AlCl–4 निर्माण sp3 संकरण के द्वारा होता है (क्योंकि AlCl–4में, Al की रिक्त 3pz, कक्षक भी संकरण में सम्मलित है) इसलिए दी गई अभिक्रिया में Al की संकरण अवस्था sp2 से sp3 में परिवर्तित होती है।।
प्रश्न 26.
क्या निम्नलिखित अभिक्रिया के फलस्वरूप B तथा N परमाणुओं की संकरण-अवस्था में परिवर्तन होता है?
BF3 + NH2 → F3 B.NH3
उत्तर :
NH3 में N की संकरण अवस्था अर्थात् sp3 अपरिवर्तित रहती है।
BF3 में बोरोन परमाणु sp2 संकरित है, जबकि F3 B.NH3 में यह sp3 संकरित है। इसलिए, दी गई अभिक्रिया में B की संकरण अवस्था sp2 से sp3 में परिवर्तित होती है।
प्रश्न 27.
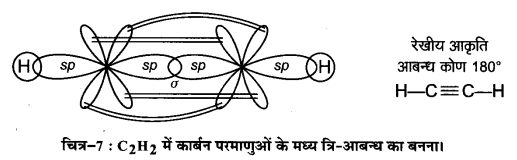
C2H4 तथा C2H2अणुओं में कार्बन परमाणुओं के बीच क्रमशः द्वि-आबन्ध तथा त्रि-आबन्ध के निर्माण को चित्र द्वारा स्पष्ट कीजिए।
उत्तर :
(i) C2H4
(ii) C2H2
प्रश्न 28.
निम्नलिखित अणुओं में सिग्मा (σ) तथा पाई (π) आबन्धों की कुल संख्या कितनी है?
(i) C2H4
(i) C2H4
उत्तर :
प्रश्न 29.
X-अक्ष को अन्तर्नाभिकीय अक्ष मानते हुए बताइए कि निम्नलिखित में कौन-से कक्षक सिग्मा (σ) आबन्ध नहीं बनाएँगे और क्यों?
(क) 1s तथा 1s,
(ख) 1s तथा 2px;
(ग) 2py तथा 2py,
(घ) 1s तथा 25
उत्तर :
(क), (ख) तथा (घ) सिग्मा (σ) आबन्ध बनायेंगे क्योंकि कक्षक गोलीय सममित (spherically symmetric) हैं।
(घ) अर्थात् 2py , तथा 2py,सिग्मा आबन्ध नहीं बना सकते, क्योंकि ये ऑर्बिटल y-अक्ष के अनुतटीय होने के कारण अक्षीय अतिव्यापन नहीं कर सकते और इस प्रकार o-आबन्ध का निर्माण नहीं कर सकते। ये केवल पार्श्ववत अतिव्यापन कर 7 आबन्धु बना सकते हैं, यदि -अक्ष अन्तरानाभिकीय अक्ष हैं।
प्रश्न 30.
निम्नलिखित अणुओं में कार्बन परमाणु कौन-से संकर कक्षक प्रयुक्त करते हैं?
(क) CH3–CH3
(ख) CH3—CH=CH2
(ग) CH3—CH2—OH
(घ) CH3CHO
(ङ) CH3COOH
उत्तर :
प्रश्न 31.
इलेक्ट्रॉनों के आबन्धी युग्म तथा एकाकी युग्म से आप क्या समझते हैं? प्रत्येक को एक उदाहरण द्वारा स्पष्ट कीजिए।
उत्तर :
दो आबन्धी सहसंयोजी परमाणुओं के बीच उपस्थित इलेक्ट्रॉन्स के सहभागी युग्म, आबन्धी युग्म कहलाते हैं। वे इलेक्ट्रॉन्स युग्म जो परमाणु पर उपस्थित होते हैं परन्तु सहसंयोजी आबन्ध निर्माण में भाग नहीं लेते हैं, एकाकी युग्म कहलाते हैं। उदाहरणार्थ-
प्रश्न 32.
सिग्मा तथा पाई आबन्ध में अन्तर स्पष्ट कीजिए।
उत्तर :
सिग्मा व पाई आबन्धों में अन्तर (Differences between Sigma and pi Bonds)
प्रश्न 33.
संयोजकता आबन्ध सिद्धान्त के आधार पर H2 अणु के विरचन की व्याख्या कीजिए।
उत्तर :
संयोजक्ता आबन्ध सिद्धान्त को सर्वप्रथम हाइटलर तथा लंडन (Heitler and London) ने सन् 1927 में प्रस्तुत किया था जिसका विकास पॉलिंग (Pauling) तथा अन्य वैज्ञानिकों ने बाद में किया। इस सिद्धान्त का विवेचन परमाणु कक्षकों, तत्वों के इलेक्ट्रॉनिक विन्यासों, परमाणु कक्षकों के अतिव्यापन और संकरण तथा विचरण (variation) एवं अध्यारोपण (superposition) के सिद्धान्तों के ज्ञान पर आधारित है। इस सिद्धान्त के आधार पर H2 अणु के विरचन की व्याख्या निम्नवत् की जा सकती है–
H(g)+H(g) → H2(g)+433 kJ mol-1
यह प्रदर्शित करता है कि हाइड्रोजन अंणु की ऊर्जा हाइड्रोजन परमाणुओं की तुलना में कम है। सामान्यत: जब कभी परमाणु संयोजित होकर अणु बनाते हैं, तब ऊर्जा में अवश्य ही कमी आती है जो स्थायित्व को बढ़ा देती है।
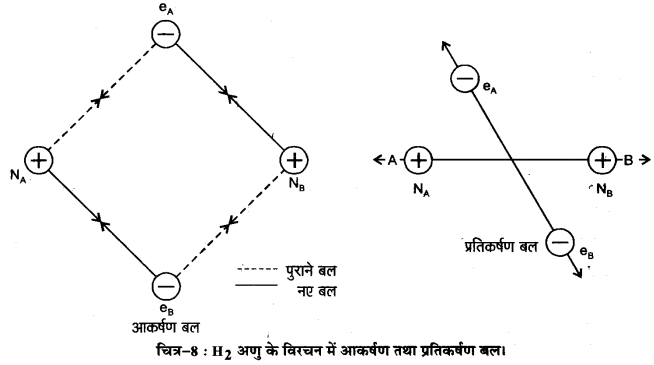
मानो हाइड्रोजन के दो परमाणु A व B, जिनके नाभिक क्रमशः NA व NB हैं तथा उनमें उपस्थित इलेक्ट्रॉनों को eA और eB द्वारा दर्शाया गया है, एक-दूसरे की ओर बढ़ते हैं। जब ये दो परमाणु एक-दूसरे से अत्यधिक दूरी पर होते हैं, तब उनके बीच कोई अन्योन्यक्रिया नहीं होती। ज्यों-ज्यों दोनों परमाणु एक-दूसरे के समीप आते-जाते हैं, त्यों-त्यों उनके बीच आकर्षण तथा प्रतिकर्षण बल उत्पन्न होते जाते हैं।
आकर्षण बल निम्नलिखित में उत्पन्न होते हैं-
- एक परमाणु के नाभिक तथा उसके इलेक्ट्रॉनों के बीच NA – eANB – eB
- एक परमाणु के नाभिक तथा दूसरे परमाणु के इलेक्ट्रॉनों के बीच NA – eB, NB – eA
इसी प्रकार प्रतिकर्षण बल निम्नलिखित में उत्पन्न होते हैं-
- दो परमाणुओं के इलेक्ट्रॉनों के बीच eA – eB तथा
- दो परमाणुओं के नाभिकों के बीच NA – NB।
आकर्षण बल दोनों परमाणुओं को एक-दूसरे के पास लाते हैं, जबकि प्रतिकर्षण बल उन्हें दूर करने का प्रयास करते हैं (चित्र-8)।
प्रायोगिक तौर पर यह पाया गया है कि नए आकर्षण बलों का मान नए प्रतिकर्षण बलों के मान से अधिक होता है। इसके परिणामस्वरूप दोनों परमाणु एक-दूसरे के समीप आते हैं तथा उनकी स्थितिज ऊर्जा कम हो जाती है। अन्ततः ऐसी स्थिति आ जाती है कि नेट आकर्षण बल, प्रतिकर्षण बल के बराबर हो जाता है और निकाय की ऊर्जा न्यून स्तर पर पहुँच जाती है। इस अवस्था में हाइड्रोजन के. परमाणु ‘आबन्धित’ कहलाते हैं और एक स्थायी अणु बनाते हैं जिसकी आबन्ध-लम्बाई 74 pm होती है।
चूंकि हाइड्रोजन के दो परमाणुओं के बीच आबन्ध बनने पर ऊर्जा मुक्त होती है, इसलिए हाइड्रोजन अणु दो पृथक् परमाणुओं की अपेक्षा अधिक स्थायी होता है। इस प्रकार मुक्त ऊर्जा ‘आबन्ध एन्थैल्पी’ कहलाती है।
यह चित्र-9 में दिए गए आरेख के संगत होती है। विलोमत: H2 के एक मोल अणुओं के वियोजन के लिए 433 kJ ऊर्जा की आवश्यकता होती है, इसे आबन्ध वियोजन ऊर्जा कहा जाता है।
H2(g) 433 kJ mol-1 → H(g)+H(g)
प्रश्न 34.
परमाणु कक्षकों के रैखिक संयोग से आण्विक कक्षक बनने के लिए आवश्यक शर्तों को लिखिए।
उत्तर :
परमाणु कक्षकों के रैखिक संयोग से आण्विक कक्षकों के निर्माण के लिए निम्नलिखित शर्ते अनिवार्य हैं-
- संयोग करने वाले परमाणु कक्षकों की ऊर्जा समान या लगभग समान होनी चाहिए। इसका तात्पर्य यह है कि एक ls कक्षक दूसरे ls कक्षक से संयोग कर सकता है, परन्तु 2s कक्षक से नहीं; क्योकि 2s कक्षक की ऊर्जा ls कक्षक की ऊर्जा से कहीं अधिक होती है। यह सत्य नहीं है, यदि परमाणु भिन्न प्रकार के हैं।
- संयोग करने वाले परमाणु कक्षकों की आण्विक अक्ष के परितः समान सममिति होनी चाहिए। परिपाटी के अनुसार, z-अक्ष को आण्विक अक्ष मानते हैं। यहाँ यह तथ्य महत्त्वपूर्ण है कि समान या लगभग समान ऊर्जा वाले परमाणु कक्षक केवल तभी संयोग करेंगे, जब उनकी सममिति समान है, अन्यथा नहीं। उदाहरणार्थ-2p, परमाणु केक्षक दूसरे परमाणु के 2p, कक्षक से संयोग करेगा, परन्तु 2p, या 22, कक्षकों से नहीं; क्योंकि उनकी सममितियाँ समान नहीं हैं।
- संयोग करने वाले परमाणु कक्षकों को अधिकतम अतिव्यापन करना चाहिए। जितना अधिक अतिव्यापन होगा, आण्विक कक्षकों के नाभिकों के बीच इलेक्ट्रॉन घनत्व उतना ही अधिक होगा।
प्रश्न 35.
आण्विक कक्षक सिद्धान्त के आधार पर समझाइए कि Bey अणु का अस्तित्व क्यों नहीं होता?
उत्तर :
Be का परमाणु क्रमांक 4 है। इसका अर्थ है कि Be2 के आण्विक कक्षक में 8 इलेक्ट्रॉन भरे जाएँगे। इसका आण्विक कक्षक विन्यास है-
KK (σ2s)2 (σ*2s)2
चूँकि आबन्ध कोटि शून्य प्राप्त होती है; अत: Be2अणु का अस्तित्व नहीं होता।
प्रश्न 36.
निम्नलिखित स्पीशीज के आपेक्षिक स्थायित्व की तुलना कीजिए तथा उनके चुम्बकीय गुण इंगित कीजिए-
O2,0+2, 0–2 (सुपर ऑक्साइड) तथा O2-2 (परऑक्साइड)
उत्तर :
दी गई स्पीशीज की आबन्ध कोटि इस प्रकार हैं-
O2 (2.0), O+2 (2.5), O–2 (1.5), O2-2 (1.0)
इनके स्थायित्व का क्रम इस प्रकार होगा-
O+2 > O2 > O–2 > O2-2
इनके चुम्बकीय गुण निम्नलिखित हैं-
- O2अनुचुम्बकीय है।
- O+2 अनुचुम्बकीय है।
- O–2 अनुचुम्बकीय है।
- O2-2 प्रतिचुम्बकीय है।
प्रश्न 37.
कक्षकों के निरूपण में उपयुक्त धन (+) तथा ऋण (-) चिह्नों का क्या महत्त्व होता है?
उत्तर :
जब संयोजित होने वाले परमाणु कक्षकों की पालियों (lobes) के चिह्न समान (अर्थात् + तथा + या – तथा:-) होते हैं, तब आबन्धी आण्विक कक्षक बनते हैं। जब संयोजित होने वाले परमाणु कक्षकों की पालियों के चिह्न असमान (अर्थात् + तथा -) होते हैं, तब प्रतिआबन्धी आण्विक कक्षक बनते हैं।
प्रश्न 38.
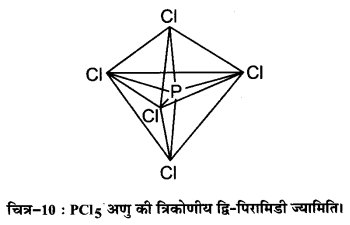
PCl5 :अणु में संकरण का वर्णन कीजिए। इसमें अक्षीय आबन्ध विषुवतीय आबन्धों की अपेक्षा अधिक लम्बे क्यों होते हैं?
उत्तर :
PCl5 अणु में sp3d-संकरण (sp3d -hybridisation in PCl5 molecule)-फॉस्फोरस परमाणु (Z=15) की तलस्थ अवस्था इलेक्ट्रॉनिक विन्यास को नीचे दर्शाया गया है। फॉस्फोरस की आबन्ध निर्माण परिस्थितियों में 3s कक्षक से एक इलेक्ट्रॉन अयुग्मित होकर रिक्त 3s2z कक्षक में प्रोन्नत हो जाता है। इस प्रकार फॉस्फोरस की उत्तेजित अवस्था के विन्यास को इस प्रकार दर्शाया जा सकता है-
इस प्रकार पाँच कक्षक (एक s, तीन p तथा एक d कक्षक) संकरण के लिए उपलब्ध होते हैं। इनके संकरण द्वारा पाँच sp3d संकर कक्षक प्राप्त होते हैं, जो त्रिकोणीय द्वि-पिरामिड के पाँच कोनों की ओर उन्मुख होते हैं, जैसा चित्र-10 में दर्शाया गया है।
यहाँ यह तथ्य ध्यान देने योग्य है कि त्रिकोणीय द्वि-पिरामिडी ज्यामिति में सभी आबन्ध कोण बराबर नहीं होते हैं। PCl5 में फॉस्फोरस के पाँच sp3 संकर कक्षक क्लोरीन परमाणुओं के अर्द्ध-पूरित कक्षकों में अतिव्यापन द्वारा पाँच PCl5 सिग्मा-आबन्ध बनाते हैं। इनमें से तीन P—Cl आबन्ध एक तल में होते हैं तथा परस्पर 120° का कोण बनाते हैं। इन्हें ‘विषुवतीय आबन्ध, (equatorial) कहते हैं। अन्य दो P—CI आबन्ध क्रमशः विषुवतीय तल के ऊपर और नीचे होते हैं तथा तल से 90° का कोण बनाते हैं। इन्हें अक्षीय आबन्ध (axial) कहते हैं। चूंकि अक्षीय आबन्ध इलेक्ट्रॉन युग्मों में विषुवतीय आबन्धी-युग्मों से अधिक प्रतिकर्षण अन्योन्यक्रियाएँ होती हैं; अतः ये आबन्ध विषुवतीय आबन्धों से लम्बाई में कुछ अधिक तथा प्रबलता में कुछ कम होते हैं। इसके परिणामस्वरूप PCl5 अत्यधिक क्रियाशील होता है।
प्रश्न 39.
हाइड्रोजन आबन्ध की परिभाषा दीजिए। यह वाण्डरवाल्स बलों की अपेक्षा प्रबल होते हैं या दुर्बल?
उत्तर :
हाइड्रोजन आबन्ध को उस आकर्षण बल के रूप में परिभाषित किया जा सकता है, जो एक अणु के हाइड्रोजन परमाणु को दूसरे अणु के विद्युत-ऋणात्मक परमाणु (F,0 या N) से बॉधता है। यह वाण्डरवाल्स बलों की अपेक्षा दुर्बल होते हैं।
प्रश्न 40.
“आबन्ध कोटि से आप क्या समझते हैं? निम्नलिखित में आबन्ध कोटि का परिकलन कीजिए-
N2, O2, O+2 तथा O–2
उत्तर :
किसी अणु यो आयन में दो परमाणुओं के बीच आबन्धों की संख्या ‘आबन्ध कोटि कहलाती है। गणितीय रूप में, यह आबन्धी तथा अनाबन्धी कक्षकों में इलेक्ट्रॉनों की संख्या में अन्तर के आधे के बराबर होती है। अर्थात्
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
दो समान या असमान परमाणुओं के मध्य परस्पर समान इलेक्ट्रॉनों के साझे के द्वारा बनने वाला आबन्ध कहलाता है।
(i) उपसहसंयोजक आबन्ध
(ii) आयनिक आबन्ध
(iii) सहसंयोजक आबन्ध
(iv) धात्विक आबन्ध
उत्तर :
(iii) सहसंयोजक आबन्ध
प्रश्न 2.
अधातु परमाणुओं के मध्य प्रायः बनता है।
(i) सहसंयोजक आबन्ध
(ii) धात्विक आबन्ध
(iii) आयनिक आबन्ध
(iv) आयनिक तथा धात्विक आबन्ध
उत्तर :
(i) सहसंयोजक ऑबन्ध
प्रश्न 3.
K4[Fe(CN)6] में किस प्रकार के बन्ध उपस्थित हैं?
(i) आयनिक बन्ध और सहसंयोजक बन्ध
(ii) आयनिक बन्ध और उपसहसंयोजक बन्ध
(iii) सहसंयोजक बन्ध और उपसहसंयोजक बन्ध ।
(iv) आयनिक बन्ध, सहसंयोजक बन्ध और उपसहसंयोजक बन्ध
उत्तर :
(iv) आयनिक बन्ध, सहसंयोजक बन्ध तथा उपसहसंयोजक बन्ध।
प्रश्न 4.
निम्नलिखित में से कौन-सा:आबन्ध दिशात्मक नहीं है?
(i) ध्रुवीय सहसंयोजक आबन्ध’
(ii) उपसहसंयोजक आबन्ध
(iii) आयनिक आबन्थे
(iv) अध्रुवीय सहसंयोजक आबन्ध
उत्तर :
(iii) आयनिक आबन्ध
प्रश्न 5.
निम्न अणुओं में से कार्वनकार्बन अन्ध लम्वाईकिस अणु में सबसे कम है।
(i) एथेन
(ii) एथीन
(iii) एथाइने
(iv) बेन्जीन
उत्तर :
(iii) एथाइन
प्रश्न 6.
निम्न में किसाबन्दोण सबसे कम है?
(i) H2S
(ii) NH3
(iii) SO2
(iv) H2O
उत्तर :
(i) H2S
प्रश्न 7.
O2 H2O तथा O3 में O—O आबश्य लम्बास क्रम है।
(i) O2 >O3 > H2O2
(ii) O3 >H2O2 > O2
(iii) H2O2 > O3 > O2
(iv) O2 > H2O2 > O3
उत्तर :
(iii) H2O2> O3 > O2
प्रश्न 8.
BF3 में F—B—F आबन्ध कोण है
(i) 180°
(ii) 90°
(iii) 120°
(iv) 1085०
उत्तर :
(iii) 120°
प्रश्न 9.
NH3 व H2O में क्रमशः आबन्ध कोण होगा
(i) 109°28 व 107°
(ii) 111° वे 109°
(iii) 107° व 104.5°
(iv) 104.5° व 107°
उत्तर :
(iii) 107° व 104.5°
प्रश्न 10.
निम्नलिखित स्पीशीज में किसकी सबसे उच्च आबन्ध कोटि होगी?
(i) O2
(ii) O2-2
(iii) O–2
(iv) O+2
उत्तर :
(iv) O+2
प्रश्न 11.
निम्नलिखित में से किसमें ध्रुवीय तथा अध्रुवीय आबन्ध दोनों हैं?
(i) NH4Cl
(ii) HCN
(iii) CH4
(iv) H2O2
उत्तर :
(iv) H2O2
प्रश्न 12.
निम्नलिखित में से किस अणु में सर्वाधिक ध्रुवीय सहसंयोजी बन्ध हैं?
(i) HI
(ii) HBr
(iii) H2
(iv) HCl
उत्तर :
(iv) परमाणुओं की विद्युत ऋणात्मकता का अन्तर बढ़ने के साथ सहसंयोजी बन्ध का ध्रुवीय लक्षण बढ़ता है। अत: H—CI में सर्वाधिक ध्रुवीय सहसंयोजी बन्ध उपस्थित हैं।
प्रश्न 13.
H2S की ज्यामिति तथा द्विध्रुव आघूर्ण है।
(i) कोणीय तथा अशून्य
(ii) कोणीय तथा शून्य
(iii) रैखिक तथा अशून्य
(iv) रैखिक तथा शून्य
उत्तर :
(i) कोणीय तथा अशून्य
प्रश्न 14.
बेन्जीन में तथा र बन्धों का अनुपात है।
(i) 2
(ii) 4
(iii) 8
(iv) 6
उत्तर :
(ii) 4
प्रश्न 15.
(i) sp3 – sp3
(ii) sp – sp2
(iii) sp3 – sp
(iv) sp2 – sp2
उत्तर :
(ii) sp – sp2
प्रश्न 16.
SO2और SO3 में s परमाणु के संकरण क्रमशः हैं।
(i) sp, sp2
(ii) sp2, sp2
(iii) sp2, sp3
(iv) sp, sp3
उत्तर :
(ii) sp2,sp2
प्रश्न 17.
पिरैमिडीय संरचना वाला अणु है।
(i) PCl3
(ii) CO2-2
(iii) NO–3
(iv) SO3
उत्तर :
(i) PCl3
प्रश्न 18.
समइलेक्ट्रॉनिक हैं।
1.CH+3
2. H3O+
3. CO
4. CH–3
(i) 1 तथा 2
(ii) 2 तथा 3
(iii) 3 तथा 4
(iv) 2 तथा 4
उत्तर :
(i) 1 तथा 2
प्रश्न 19.
निम्नलिखित हाइड्रोजन आबन्धों में से कौन प्रबलतम है?
(i) O—H……0
(ii) O—H……F
(iii) O—H……N
(iv) F—H……F
उत्तर :
(iv) F—H……F
प्रश्न 20.
H2S गैस है जबकि H2O द्रव है। इसका कारण है।
(i) H2O की ध्रुवता
(ii) H2O की तुलना में H2S का अधिक अणुभार
(iii) H2O में हाइड्रोजन बन्धन
(iv) इनमें से कोई नहीं
उत्तर :
(iii) H2O में हाइड्रोजन बन्धन
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
सहसंयोजक आबन्ध की परिभाषा आबन्ध युग्म और एकाकी युग्म को समझाते हुए दीजिए।
उत्तर :
परमाणुओं द्वारा इलेक्ट्रॉनों की बराबर की साझेदारी द्वारा जो आबन्ध बनता है उसे सहसंयोजक आबंन्ध कहते हैं।
आबन्ध युग्म–जिन साझे के इलेक्ट्रॉन युग्मों द्वारा सहसंयोजक आबन्ध का निर्माण होता है उन्हें इलेक्ट्रॉनों का आबन्ध युग्म कहते हैं। एकाकी युग्म–जो संयोजी इलेक्ट्रॉन आबन्धन अथवा साझे में भाग नहीं लेते हैं उन्हें इलेक्ट्रॉनों का एकाकी युग्म कहते हैं।
प्रश्न 2.
सहसंयोजकता को उदाहरण देते हुए स्पष्ट कीजिए।
उत्तर :
किसी तत्त्व के एक परमाणु द्वारा दूसरे परमाणुओं के साथ बनाए गये सहसंयोजक आबन्धों की कुल संख्या उस तत्त्वे की संयोजकता अथवा सहसंयोजकता कहलाती है। उदाहरणार्थ–एथिलीन (C2H4) में कार्बन की सहसंयोजकूता चार है।
प्रश्न 3.
संयोजकता इलेक्ट्रॉन से आप क्या समझते हैं?
उत्तर :
तत्वों के बाह्यतम कोश को संयोजकता कोश कहते हैं तथा इन कोश में उपस्थित इलेक्ट्रॉन को संयोजकता इलेक्ट्रॉन कहते हैं।
प्रश्न 4.
उपसहसंयोजक आबन्ध को स्पष्ट कीजिए।
उत्तर :
वह आबन्ध जिसमें दो परमाणु परस्पर साझे के इलेक्ट्रॉन युग्म द्वारा बँधे रहते हैं परन्तु साझे का इलेक्ट्रॉन युग्म केवल एक परमाणु द्वारा दिया जाता है, उपसहसंयोजक अथवा दाता आबन्ध कहलाता है।
प्रश्न 5.
HNO3 अणु में आबन्धों की प्रकृति की विवेचना कीजिए।
उत्तर :
HNO3 की संरचना निम्नवत् है
उपर्युक्त संरचना से स्पष्ट है कि HNO3अणु में एक उपसहसंयोजी तथा शेष सहसंयोजी आबन्ध हैं।
प्रश्न 6.
वैद्युत संयोजी आबन्ध या आयनिक आबन्ध की परिभाषा लिखिए।
उत्तर :
परमाणुओं के मध्य इलेक्ट्रॉनों के स्थानान्तरण से जो आबन्ध बनते हैं, उन्हें वैद्युत संयोजी आबन्ध या आयनिक आबन्ध कहते हैं।
उदाहरणार्थ-सोडियम क्लोराइड (NaCl) में Na परमाणु अपने बाह्यतम कोश का एक इलेक्ट्रॉन Cl परमाणु को देकर अक्रिय गैस की स्थायी संरचना प्राप्त करके सोडियम आयन में परिवर्तित हो जाता है। इसी प्रकार C1 परमाणु अपने बाह्यतम कोश के Na परमाणु से एक इलेक्ट्रॉन लेकर अक्रिय गैस की स्थायी संरचना प्राप्त कर लेता है और क्लोराइड आयन बनाता है।
प्रश्न 7.
आयनिक यौगिक क्या हैं? एक उदाहरण देकर समझाइए।
उत्तर :
वे रासायनिक यौगिक जिनमें आयन आयनिक आबन्धों के द्वारा जुड़कर एक जालक संरचना का निर्माण करते हैं, आयनिक यौगिक कहलाते हैं। उदाहरणार्थ-सोडियम क्लोराइड (NaCl) एक आयनिक यौगिक है।
प्रश्न 8.
‘कार्बन सहसंयोजी यौगिक बनाता है, जबकि सोडियम वैद्युत संयोजी।’ कारण सहित स्पष्ट कीजिए।
उत्तर :
कार्बन के संयोजी कोश में चार इलेक्ट्रॉन होते हैं जिन्हें त्यागना अथवा किसी अन्य परमाणु से चार अतिरिक्त इलेक्ट्रॉन ग्रहण करके अष्टक पूर्ण करना असम्भव है; अत: कार्बन इलेक्ट्रॉनों के साझे से सहसंयोजी बन्ध बनाता है जिसके परिणामस्वरूप सहसंयोजी यौगिक बनते हैं जबकि सोडियम के संयोजी कोश में केवल एक इलेक्ट्रॉन होता है जिसे यह आसानी से त्यागकर किसी अन्य परमाणु के साथ वैद्युत संयोजी बन्ध बना लेता है जिसके फलस्वरूप वैद्युत संयोजी बन्ध बनते हैं।
प्रश्न 9.
H3O+ तथा Na2S की इलेक्ट्रॉनिक संरचना लिखिए। इसमें उपस्थित बन्धों के प्रकार भी लिखिए।
उत्तर :
H3O+ की इलेक्ट्रॉन बिन्दु संरचना
अतः इसमें दो सहसंयोजक तथा एक उपसहसंयोजक बन्ध उपस्थित हैं।
Na2S की इलेक्ट्रॉन बिन्दु संरचना
अतः इसमें केवल विद्युत संयोजक बन्ध उपस्थित हैं।
प्रश्न 10.
निम्नलिखित यौगिकों को उनके आयनिक लक्षण के बढ़ते हुए क्रम में लिखिए
MgCl2, AlCl3, BeCl2, CCl4
उत्तर :
CCl4 < BeCl2 < AlCl3 < MgCl2
प्रश्न 11.
समझाइए की HF का क्वथनांक HCI के क्वथनांक से ऊँचा क्यों है?
उत्तर :
HF अणुओं के मध्य हाइड्रोजन आबन्ध उपस्थित होता है जिसके कारण यह एक विशाल अणु का आकार ग्रहण कर लेता है। इस अवस्था परिवर्तन के लिए अधिक ऊर्जा व्यय होती है। इसके विपरीत, HCl अणुओं के मध्य हाइड्रोजन आबन्ध अनुपस्थित होता है। इसीलिए HF का क्वथनांक HCI से अधिक होता है।
प्रश्न 12.
कक्षक अतिव्यापन कितने प्रकार के होते हैं? प्रत्येक को एक उदाहरण देकर समझाइए।
उत्तर :
कक्षक अतिव्यापन निम्नलिखित दो प्रकार के होते हैं-
- अक्षों पर अतिव्यापन-इस अतिव्यापन से सिग्मा (G)आबन्ध बनता है। उदाहरणार्थ-HCI अणु में H के -कक्षक CI के p-कक्षक से उसके अक्ष पर ठ-आबन्ध का निर्माण करते हैं।
- पाश्र्व रूप में अतिव्यापन-इस अतिव्यापन में पाई (π) आबन्ध बनता है। उदाहरणार्थ-एथिलीन के अणु में।
प्रश्न 13.
परमाणु कक्षकों के अतिव्यापन से आप क्या समझते हैं?
उत्तर :
हाइड्रोजन अणु के विरचन में जब H-परमाणु न्यूनतम ऊर्जा अवस्था में होते हैं तो ऐसे में वे एक-दूसरे के इतने पास पहुँच जाते हैं कि उनके कक्षक एक-दूसरे में प्रवेश कर जाते हैं। इस परिघटना को परमाणु कक्षकों का अतिव्यापन कहते हैं।
प्रश्न 14.
या
एकल आबन्ध यौगिक की तुलना में द्वि-आबन्ध यौगिक अधिक क्रियाशील क्यों होते हैं?
उत्तर :
एकल आबन्ध यौगिक की तुलना में द्वि-आबन्ध यौगिक अधिक क्रियाशील होते हैं: क्योकि एक द्वि-आबन्ध में एक सिग्मा-आबन्ध तथा एक पाई-आबन्ध होते हैं जिसे तोड़ने के लिए लगभग 143 किलोकैलोरी ऊर्जा की आवश्यकता होती है, जबकि एकल आबन्ध में केवल एक सिग्मा-आबन्ध होता है। जिसे तोड़ने के लिए मात्र 83 किलोकैलोरी ऊर्जा की आवश्यकता होती है।
प्रश्न 15.
निम्नलिखित यौगिक में प्रत्येक कार्बन परमाणु की संकरण अवस्था बताइए
उत्तर :
प्रश्न 16.
निम्नलिखित में प्रत्येक कार्बन का संकरण बताइए
उत्तर :
प्रश्न 17.
नीचे दी गई संरचनाओं (i) तथा (ii) द्वारा H3PO3 को प्रदर्शित किया जा सकता है। क्या ये दो संरचनाएँ H3PO3 के अनुनाद संकर के विहित (केनॉनीकाल) रूप माने जा सकते , हैं? यदि नहीं, तो उसका कारण बताइए।
उत्तर :
दी गई संरचनाओं (i) तथा (i) में हाइड्रोजन परमाणु की स्थिति समान नहीं है। परमाणुओं की स्थिति में परिवर्तन होने के कारण, ये H3PO3 के अनुनाद संकर के विहित (केनॉनीकल) रूप नहीं माने जा सकते हैं।
प्रश्न 18.
अनुनाद संकर तथा अनुनाद से आप क्या समझते हैं?
उत्तर :
जब किसी अणु के लिए एक से अधिक लूईस संरचनाएँ लिखी जा सकती हों जिनमें से। प्रत्येक संरचना अणु के अधिकांश गुणों की व्याख्या कर सकती हो परन्तु कोई भी अणु के सभी गुणों की व्याख्या न कर पाए तो ऐसी स्थिति में अणु की वास्तविक संरचना इन सभी संरचनाओं की मध्यवर्ती होती है तथा इसे अनुनाद संकर कहते हैं और इस प्रक्रम को अनुनाद कहते हैं।
प्रश्न 19.
HF द्रव है जबकि HCI गैस। कारण सहित स्पष्ट कीजिए।
उत्तर :
HCl की तुलना में HF के अणुओं के मध्य अन्तरा-आणविक आकर्षण बल अधिक पाया जाता है जिसके कारण उनके अणु आपस में बंधे रहते हैं। इसलिए HF द्रव है जबकि HCl गैस।
लघु उत्तरीय प्रश्न
प्रश्न 1.
अमोनिया एक सहसंयोजी यौगिक है। इसे जल में घोलने पर प्राप्त विलयन विद्युत का सुचालक होता है, क्यों? समझाइए।
उत्तर :
हाइड्रोजन क्लोराइड और अमोनिया दोनों ही सहसंयोजी यौगिक हैं। इनमें ध्रुवीय सहसंयोजक आबन्ध होते हैं जिनके कारण इन दोनों यौगिकों में उपस्थित विषम परमाणुओं; जैसे—HCI में H तथा CI एवं NH3 में H तथा N पर क्रमशः आंशिक धनावेश (δ+) एवं आंशिक ऋणावेश (δ–) आ जाते
उच्च डाइइलेक्ट्रिक स्थिरांक वाले जल में इन्हें घोलने पर इनमें ध्रुवीय आबन्ध टूट जाते हैं तथा इन यौगिकों में क्रमशः उपस्थित हाइड्रोजन एवं क्लोराइड तथा हाइड्रोजन एवं नाइट्रोजन आयनों के रूप में पृथक् हो जाते हैं जिसे जलीय विलयन में हाइड्रोजन क्लोराइड तथा अमोनिया का आयनन कहते हैं। इस प्रकार जलीय विलयन में मुक्त आयनों की उपस्थिति के कारण हाइड्रोजन क्लोराइड तथा अमोनिया विद्युत के सुचालक होते हैं।
प्रश्न 2.
इलेक्ट्रॉन युग्म दाता से आप क्या समझते हैं? एक उदाहरण द्वारा स्पष्ट कीजिए।
उत्तर :
जब किसी अणु के परसाणु का अष्टक पूर्ण हो जाता है तथा उस पर एक, दो या तीन इलेक्ट्रॉन युग्म मुक्त होते हैं (जो सहसंयोजक ओबन्ध के निर्माण के साझे में प्रयुक्त ने हुए हों) तो इनमें से एक इलेक्ट्रॉन युग्म किसी ऐसे परमाणु का जिसका अष्टक पूर्ण न हो, दान करके या साझा करते हैं, फलस्वरूप उपसहसंयोजक आबन्ध का निर्माण होता है। इस इलेक्ट्रॉन युग्म को दान करने वाले अणु को इलेक्ट्रॉन युग्म दाता कहते हैं। उदाहरणार्थ-NH3 के अणु से नाइट्रोजन एक इलेक्ट्रॉन युग्म BF3 के अणु को दान करके साझा करते हैं जिससे उपसहसंयोजक आबन्ध का निर्माण होता है।
प्रश्न 3.
आयनिक यौगिक ठोस एवं कठोर क्यों होते हैं? समझाइए।
उत्तर :
सामान्यतः आयनिक यौगिक क्रिस्टलीय ठोसों (crystalline solids) के रूप में पाए जाते हैं। आयनिक यौगिकों में अणु (molecules) नहीं बल्कि आयन होते हैं। हम किसी आयनिक यौगिक के किसी आयन युग्म को चुनकर उसे अणु नहीं कह सकते। आयनिक यौगिकों में आयन त्रिविमीय स्थान में एक निश्चित ज्यामितीय प्रतिरूप (geometric pattern) में व्यवस्थित रहते हैं। उदाहरणार्थ-सोडियम क्लोराइड क्रिस्टल में प्रत्येक सोडियम आयन (Na+) छः क्लोराइड आयनों (Cl–) तथा प्रत्येक क्लोराइड आयन (Cl–) छ: सोडियम आयनों (Na+) से घिरा रहता है। आयनों के आकार तथा उन पर उपस्थित आवेश के आधार पर आयनों का क्रम विभिन्न यौगिकों में अलग-अलग होता है।
प्रश्न 4.
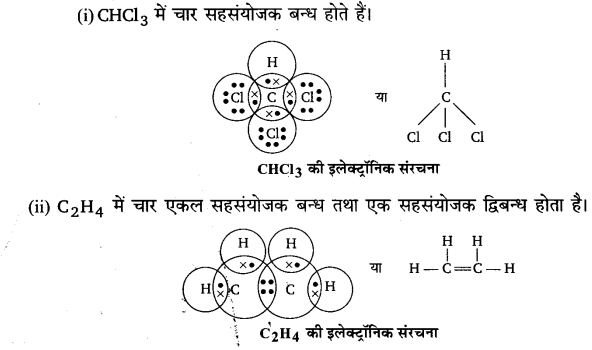
निम्नलिखित के इलेक्ट्रॉन बिन्दु सूत्र (इलेक्ट्रॉनिक सूत्र, इलेक्ट्रॉनिक संरचना या लूईस बिन्दु सूत्र) लिखिए।
(i) CHCl3,
(ii) C2H4,
(ii) PCl5,
(iv) SO2,
(v) SO3,
(vi) HNO3,
(vii) H2SO4,
(viii) H3PO3,
(ix) H3PO4,
(x) NH+4,
(xi) NO–3,
(xii) SO2-4,
(xiii) NH4Cl,
(xiv) NH4Br,
(xv) CaCl2,
(xvi) K4[Fe(CN)6,
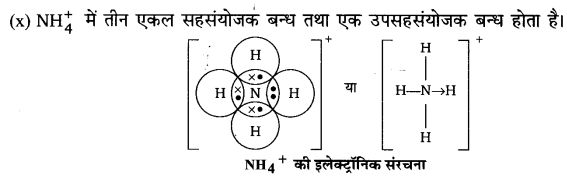
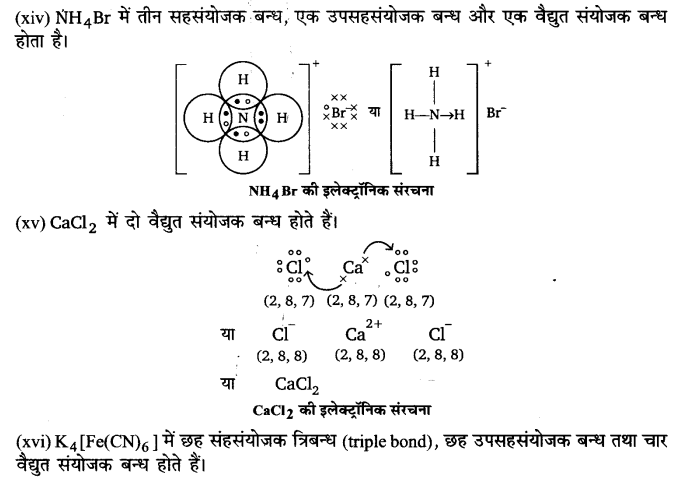
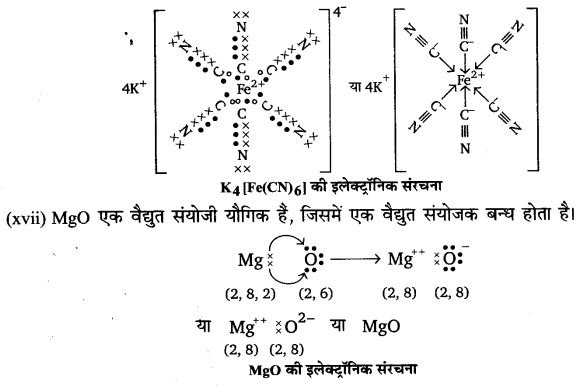
(xvii) MgO
उत्तर :
प्रश्न 5.
स्पष्ट करते हुए लिखिए कि किस प्रकार का आबन्ध बनता है जब परमाणुओं की
(i) विद्युल ऋणात्मकता का अन्तर शून्य है?
(ii) विद्युत ऋणात्मकता को अन्तर कम है?
उत्तर :
(i) जब परमाणुओं की विद्युत ऋणात्मकता का अन्तर शून्य होता है, तब अध्रुवीय सहसंयोजक आबन्ध बनता है क्योंकि विद्युत ऋणात्मकता का अन्तर शून्य होने पर साझी किया गया इलेक्ट्रॉन युग्म दोनों परमाणुओं के नाभिकों के ठीकं मध्य में स्थित होता है। इस यौगिक में अणु के धनात्मक तथा ऋणात्मक आवेश के केन्द्र एक-दूसरे के सम्पाती हो जाते हैं। ऐसे अणु उदासीन होते हैं अर्थात् इनमें नेट द्विध्रुव आघूर्ण शून्य होता है।
(ii) जब परमाणुओं की विद्युत ऋणात्मकता का अन्तर कम होता है, तब ध्रुवीय सहसंयोजक आबन्ध बनता है। क्योंकि विद्युत ऋणात्मकता में अन्तर होने पर एक परमाणु जो अधिक ऋणविद्युती होता है। की प्रवृत्ति सहसंयोजी आबन्ध के इलेक्ट्रॉन युग्म को अपनी ओर खींचने की होती है। इसलिए वह इलेक्ट्रॉन युग्म सही रूप से अणु के केन्द्र में नहीं होता है। इस कारण एक परमाणु पर ऋणावेश (जिसकी विद्युत ऋणात्मकता अधिक है) तथा दूसरे परमाणु पर धनावेश (जिसकी विद्युत ऋणात्मकता कम है) उत्पन्न हो जाता है। इनके बीच नेट द्विध्रुव आघूर्ण शून्य नहीं होता है।
प्रश्न 6.
HCI, H2O, NH3 तथा H2S में H2O का क्वथनांक सबसे अधिक होता है, क्यों? समझाइए।
उत्तर :
ऐसाH20 में प्रबल होइड्रोजन आबन्ध की उपस्थिति के कारण होता है। HCI में हाइड्रोजन आबन्ध नहीं होता। यद्यपि NH, में अन्तरा-अणुक हाइड्रोजन आबन्ध विद्यमान होता है, परन्तु नाइट्रोजन की तुलना में ऑक्सीजन की अधिक विद्युत ऋणात्मकता के कारण H…0 आबन्ध N…H आबन्ध से अधिक प्रबल होता है; अत: H20 का क्वथनांक उच्च होता है।
विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
वैद्युत संयोजी (आयनिक), सहसंयोजी तथा उपसहसंयोजी यौगिकों के मुख्य लक्षण लिखिए।
उत्तर :
वैद्युत संयोजी (आयनिक) यौगिकों के मुख्य लक्षण वैद्युत संयोजी यौगिकों के मुख्य लक्षण निम्नवत् हैं-
- इन यौगिकों के क्रिस्टल धनावेशित और ऋणावेशित आयनों से बने होते हैं अर्थात् ये यौगिक अणुओं से न बनकर आयनों से बने होते हैं; अत: इन्हें आयनिक यौगिक भी कहा जाता है।
- वैद्युत संयोजी यौगिक क्योकि धन तथा ऋण आयनों से बने होते हैं; अत: इनके अणुओं के मध्य विपरीत आवेशित आयनों के बीच वैद्युत आकर्षण बल उत्पन्न हो जाता है, फलस्वरूप स्थिर क्रिस्टल जालक होता है जिसको तोड़ने में अधिक ऊर्जा लगती है, क्योंकि व्यय ऊर्जा तापक्रम के समानुपाती होती है; इसलिए इन यौगिकों के अवस्था परिवर्तन के ताप अर्थात् क्वथनांक और गलनांक अधिक ऊँचे होते हैं।
- वैद्युत संयोजी यौगिक जल तथा अन्य ध्रुवीय विलायकों में तथा कार्बनिक विलायकों में अविलेय होते हैं। जल तथा अन्य ध्रुवीय विलायकों में घोलने पर इन यौगिकों के आयनन के फलस्वरूप वैद्युत आकर्षण बल कमजोर हो जाता है, क्योंकि ध्रुवीय विलायकों का परावैद्युत स्थिरांक उच्च होता है \left( \because \quad F\propto \frac { 1 }{ D } \right) इसलिए वे आयनित हो जाते हैं, फलस्वरूप वे विलेय हो जाते हैं, जबकि • कार्बनिक विलायकों में इनका आयनन नहीं होता, क्योंकि उनका परावैद्युत स्थिरांक कम होता है; अतः इनमें वे अविलेय रहते हैं।
- आयनिक यौगिक गलित अवस्था तथा जलीय विलयन में आयनों में विभक्त रहते हैं, इसीलिए इस | अवस्था में ये विद्युत के सुचालक होते हैं, जबकि ठोस अवस्था में विद्युत के कुचालक होते हैं।
- ये यौगिक जलीय विलयन में आयनों के रूप में रहते हैं, इसीलिए इनकी अभिक्रियाएँ तात्कालिक होती हैं।
- इन यौगिकों के बन्ध अदिशात्मक होते हैं जिसके कारण ये समावयवता व्यक्त नहीं करते हैं।
- वैद्युत संयोजक यौगिकों की रासायनिक अभिक्रियाओं में इनके आयन भाग लेते हैं तथा इनसे सम्बन्धित अभिक्रियाओं को आयनिक अभिक्रियाएँ कहते हैं।
सहसंयोजी यौगिकों के मुख्य लक्षण
सहसंयोजी यौगिकों के मुख्य लक्षण निम्नवत् हैं।
- सामान्यत: ये यौगिक ताप्न तथा दाब की साधारण परिस्थितियों में गैस या द्रव हैं। अणुभार अधिक होने पर ये ठोस होते हैं। क्योकि इनके अणुओं के मध्य दुर्बल वाण्डरवाल्स बल होता है।
- इने यौगिकों के अणु परस्पर दुर्बल वाण्डरवाल्स बन्ध से जुड़े होते हैं और इनमें आकर्षण बल | बहुत कम होता है; अतः अणुओं के मुक्त होने में अधिक ऊर्जा नहीं लगती है। इस कारण इनमें कम ताप पर अवस्था परिवर्तन हो जाता है और ये वाष्पित हो जाते हैं जिसके कारण इनका गलनांक तथा क्वथनांक कम होता है।
- ये यौगिक आयनित नहीं होते हैं; अत: गलित अवस्था या विलयन में ये विद्युत के कुचालक होते हैं।
- आयनित न होने के कारण ये यौगिक जल तथा ध्रुवीय विलायकों में अविलेय हैं, किन्तु अध्रुवीय कार्बनिक विलायकों में प्रायः विलेय होते हैं।
- इनकी अभिक्रियाएँ प्रायः धीरे-धीरे होती हैं; क्योंकि ये आण्विक अभिक्रियाएँ देते हैं।
- इन यौगिकों के बन्ध दिशात्मक होते हैं; इस कारण ये समावयवता के गुण व्यक्त करते हैं।
उपसहसंयोजी यौगिकों के मुख्य लक्षण
उपसहसंयोजी यौगिकों के मुख्य लक्षण निम्नवत् हैं।
- ये यौगिक आयनित नहीं होते हैं; अत: जल में अविलेय होते हैं, परन्तु कार्बनिक विलायकों में विलेय होते हैं।
- इन यौगिकों की प्रकृति आयनिक यौगिकों और सहसंयोजी यौगिकों के बीच की होती है; अत: इनका गलनांक तथा क्वथनांक आयनिक यौगिकों की अपेक्षा कम और सहसंयोजी यौगिकों की अपेक्षा अधिक होता है।
- ये यौगिक साधारणत: जल में वियोजित नहीं होते, इसलिए इनके विलयन में आयन नहीं होते हैं।
- ये यौगिक आयनित नहीं होते; अतः विद्युत के कुचालक होते हैं।
- सहसंयोजक यौगिकों की रासायनिक अभिक्रियाओं में इनके अणु भाग लेते हैं। इस प्रकार की अभिक्रियाओं को आणविक अभिक्रियाएँ कहते हैं।
- इनके बन्ध दिशात्मक तथा सुदृढ़ होते हैं; अतः इनमें स्थान समावयवता पाई जाती है।
प्रश्न 2.
निम्न गुणों के आधार पर वैद्युत संयोजक तथा सहसंयोजक यौगिकों में अन्तर स्पष्ट कीजिए।
(i) वैद्युत चालकता,
(ii) गलनांक तथा क्वथनांक,
(iii) ध्रुवीय तथा अध्रुवीय विलायकों में विलेयता।
उत्तर :
(i) वैद्युत चालकता—वैद्युत संयोजक यौगिक आयनों द्वारा बने होते हैं चूंकि शुष्क एवं ठोस अवस्था में आयन मुक्त नहीं होते हैं। इसलिए वैद्युत संयोजी यौगिक ठोस अवस्था में वैद्युत के कुचालक होते हैं। गलित अवस्था या विलयन में मुक्त आयन उपस्थित होते हैं। इसलिए वैद्युत संयोजी यौगिक जलीय विलयन में या गलित अवस्था में विद्युत के चालक होते हैं। सामान्यतः सहसंयोजी यौगिक वैद्युत के कुंचालक होते हैं क्योंकि इनमें मुक्त आयन नहीं पाये जाते हैं।
(ii) गलनांक तथा क्वथनांक-वैद्युत संयोजी यौगिक धनावेशित एवं ऋणावेशित आयनों से बने होते हैं जो एक-दूसरे को वैद्युत आकर्षण बल द्वारा बांधे रखते हैं जिससे इनके क्रिस्टल जालक को तोड़ने में अधिक ऊर्जा व्यय करनी पड़ती है। इसलिए वैद्युत संयोजी यौगिक के गलनांक व क्वथनांक उच्च होते हैं। सहसंयोजी यौगिकों के अणुओं के मध्य कार्यरत् बल क्षीण होता है। इसलिए इनके गलनांक व क्वथनांक वैद्युत संयोजी यौगिकों की तुलना में कम होते हैं।
(iii) ध्रुवीय तथा अध्रुवीय विलायकों में विलेयता–वैद्युत संयोजी यौगिक प्रायः ध्रुवीय विलायकों में विलेय होते हैं परन्तु अध्रुवीय विलायकों में अविलेय होते हैं जबकि सहसंयोजी यौगिक अध्रुवीय विलायकों में विलेय परन्तु ध्रुवीय विलायकों में अविलेय होते हैं।
प्रश्न 3.
फजान के नियम की व्याख्या कीजिए। फजान्स नियम के आधार पर निम्न युग्मों में स्पष्ट कीजिए कि कौन-सा यौगिक अधिक आयनिक है
(i) LiCl, CSCl
(ii) BeCl2, BCl3
(iii) SnC2, SnCl4
उत्तर :
आयनिक यौगिक में सहसंयोजक लक्षण का अध्ययन फजान्स के नियम की सहायता से किया जाता है। इस नियम के अनुसार आयन के ध्रुवण के लिए अनुकूलतम परिस्थितियाँ निम्नलिखित हैं।
- धनायन के छोटे साइज और उच्च आवेश द्वारा ऋणायन का ध्रुवण अधिक होता है अर्थात् सहसंयोजी लक्षण अधिक होता है।
- ऋणायन का साइज जितना बड़ा होता है उसका उतना ही अधिक ध्रुवण होता है अर्थात् सहसंयोजी लक्षण बढ़ता है।
- धनायन पर जितना अधिक आवेश होगा उसकी ध्रुवण क्षमता उतनी ही अधिक होगी अर्थात् सहसंयोजी लक्षण उतना ही अधिक होगा।उदाहरणार्थ-FeCl2 की तुलना में FeCl3 अधिक सहसंयोजी लक्षण प्रदर्शित करता है। क्योंकि FeCl3 में Fe पर +3 आवेश है।
- वे धनायन जिनके बाह्य कोश में 18 इलेक्ट्रॉन होते हैं उनमें अधिक सहसंयोजी लक्षण होता है।
- CsCl> LiCl चूंकि Cst का आकार Li+ से बड़ा है इसलिए CSCI, LiCI की तुलना में अधिक आयनिक है।
- BCl3, BeCl2की तुलना में अधिक आयनिक है।
- SnCl4, SnCl2की तुलना में अधिक आयनिक है क्योकि SnCl2 में Sn2+ तथा SnCl4 में Sn4+ है।
प्रश्न 4.
VSEPR (संयोजकता कोश इलेक्ट्रॉन युग्म प्रतिकर्षण) सिद्धान्त के आधार पर निम्नलिखित अणुओं की ज्यामितियों एवं आकृतियों की विवेचना कीजिए।
(i) PF5,
(ii) CH4 तथा
(iii) BeF2
उत्तर :
(i) फॉस्फोरस पेण्टाफ्लुओराइड PF5 -फॉस्फोरस परमाणु का परमाणु क्रमांक 15 है। तथा इसका इलेक्ट्रॉनिक विन्यास 2, 8, 5 है। फॉस्फोरस के संयोजकता कोश में उपस्थित पाँच इलेक्ट्रॉन, पाँच फ्लुओरीन परमाणुओं के इलेक्ट्रॉनों के साथ आबन्धी युग्म बनाते हैं। चूँकि केन्द्रीय . परमाणु समान ‘परमाणुओं के साथ सभी आबन्धी युग्मों द्वारा घिरा रहता है; अतः अणु की ज्यामिती नियमित होगी। इलेक्ट्रॉनों के सभी साझे युग्मों में प्रतिकर्षण बल न्यूनतम करने के लिए PF5 की वास्तविक आकृति त्रिकोणीय द्विपिरैमिडी होगी। P परमाणु, एक समबाहु त्रिभुज के केन्द्र पर स्थित है। तथा तीन P-F(∝) आबन्ध (इन्हें विषुवतीय आबन्ध कहा जाता है), 120° आबन्ध कोण के साथ त्रिभुज के तीनों कोनों पर निर्देशित हैं। शेष दो P-F(∝) आबन्ध (इन्हें अक्षीय बन्ध कहा जाता है) त्रिकोण के तल के ऊपर तथा नीचे तल के समकोण पर स्थित होते हैं।
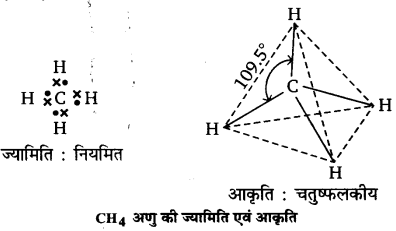
(ii) मेथेन (CH4)-मेथेन में केन्द्रीय कार्बन परमाणु को इलेक्ट्रॉनिक विन्यास 2, 4 है। संयोजकता कोश में उपस्थित चार इलेक्ट्रॉन हाइड्रोजन परमाणुओं के इलेक्ट्रॉनों के साथ साझे युग्म बनाते हैं। कार्बन परमाणु के समीप सभी साझे युग्मों की उपस्थिति के कारण मेथेन की ज्यामिति नियमित होती है। इलेक्ट्रॉन-युग्मों में प्रतिकर्षण बल न्यूनतम करने के लिए अणु की आकृति आबन्ध कोण 109.5° के साथ चतुष्फलकीय होती है।
(iii) बेरीलियम फ्लुओराइड(BeF2)-BeF2 परमाणु का परमाणु क्रमांक 4 है तथा इसका इलेक्ट्रॉनिक विन्यास 2, 2 है। संयोजकता कोश में उपस्थित दो इलेक्ट्रॉन, दो फ्लुओरीन परमाणुओं के अयुग्मित । इलेक्ट्रॉन के साथ दो साझे युग्म बनाते हैं। चूंकि Be समान परमाणुओं के साथ इलेक्ट्रॉनों के दोनों साझे ‘ युग्मों द्वारा घिरा रहता है, इसलिए अणु की ज्यामिति नियमित है। इन इलेक्ट्रॉन युग्मों में प्रतिकर्षण बल न्यूनतम करने हेतु अणु की रैखिक आकृति है।
प्रश्न 5.
कक्षक अतिव्यापन अवधारणा के आधार पर निम्नलिखित सहसंयोजी अणुओं के विरचन की व्याख्या कीजिए
(i) H2O
(ii) O2
(iii) HF
(iv) F2
उत्तर :
(i) जल अणु H2O-H2O अणु के बनने में ऑक्सीजन परमाणु के दो अर्द्धपूरित कक्षक, हाइड्रोजन परमाणुओं के अर्द्धपूरित कक्षक (1s) के साथ संयोजित होते हैं; अत: ऑक्सीजन परमाणु दो हाइड्रोजन परमाणुओं के साथ एकल सहसंयोजी बन्ध द्वारा जुड़ता है।
(ii) ऑक्सीजन अणु (O2)-ऑक्सीजन का परमाणु क्रमांक 8 है तथा इसका इलेक्ट्रॉनिक विन्यास 11s2,2s2 2p2x 2p1y, 2p1z है। इसका अर्थ है कि ऑक्सीजन में दो अर्द्धपूरित कक्षक हैं। विपरीत चक्रण वाले इलेक्ट्रॉनों के अर्द्धपूरित कक्षकों के अतिव्यापन के परिणामस्वरूप दो ऑक्सीजन परमाणु संयोजित होकर ऑक्सीजन अणु बनाते हैं।
(iii) हाइड्रोजन फ्लुओराइड अणु (HF)-फ्लुओरीन परमाणु में एक अर्द्धपूरित परमाणु कक्षक होता है। हाइड्रोजन परमाणु (Z= 1) के 1s कक्षक में केवल एक इलेक्ट्रॉन होता है। अत: आबन्ध बनने में भाग ले रहे परमाणुओं से सम्बन्धित अर्द्धपूरित कक्षकों के अतिव्यापन के परिणामस्वरूप HF अणु बनता है।
(iv) फ्लुओरीन अणु (F2)-फ्लुओरीन का परमाणु क्रमांक 9 है तथा इसका कक्षक इलेक्ट्रॉनिक विन्यास 1s2,2s2 2p2x 2p2y, 2p1z है; अतः फ्लुओरीन परमाणु में एक अर्द्धपूरित परमाणु कक्षक है। इन अर्द्धपूरित परमाणु कक्षकों के अतिव्यापन के फलस्वरूप फ्लुओरीन परमाणु संयोजित होकर फ्लुओरीन अणु बनाते हैं। इसे संलग्न चित्र में दर्शाया गया है। दोनों परमाणु एकल सहसंयोजी आबन्ध द्वारा जुड़े हुए हैं।
प्रश्न 6.
निम्न को समझाइए
(i) BF3 की ज्यामितीय समतल त्रिकोणीय है।
(ii) LiCI कार्बनिक विलायकों में घुलनशील है।
(iii) बर्फ का आयतन पानी के आयतन से अधिक होता है।
उत्तर :
1. मूल अवस्था में B की इलेक्ट्रॉनिक विन्यास 1s2 2s2 2p1 होता है। उत्तेजित अवस्था में इसका एक 2s इलेक्ट्रॉन 2p कक्षक में चला जाता है जिससे इसमें तीन अयुग्मित इलेक्ट्रॉन हो जाते हैं। इसके 2s, px अथवा , एवं 2pz कक्षक संकरित होकर समान ऊर्जा के तीन sp2 कक्षक बनाते हैं। 120° कोण पर व्यवस्थित ये तीनों sp2 कक्षक F परमाणु के 2p कक्षकों के साथ संयोग करके तीन σ बन्ध बनाते हैं इसलिए BF3,की ज्यामितीय समतल त्रिकोणीय है।
2. LiCI अणु में अधिक सहसंयोजी लक्षण होने के कारण यह कार्बनिक विलायकों में घुलनशील है। फजान्स के नियमानुसार, छोटे धनायन तथा बड़े ऋणायन में सहसंयोजी लक्षण अधिक होते हैं।
3. H2O के अणुओं के मध्य हाइड्रोजन बन्ध होने के कारण H2O के अणुओं का संगुणन हो जाता है। इसलिए समान भार की बर्फ का आयतन, पानी से अधिक होता है।
प्रश्न 7.
हाइड्रोजन बन्ध क्या है? उसके कितने प्रकार हैं? हाइड्रोजन बन्ध की प्रकृति तथा उसके कारण पदार्थ के गुणों पर प्रभाव को लिखिए।
उत्तर :
जब किसी अणु में हाइड्रोजन तथा कोई अत्यधिक विद्युत ऋणात्मक परमाणु सहसंयोजक आबन्ध द्वारा जुड़े होते हैं, तो उसमें साझे के इलेक्ट्रॉन युग्म अधिक ऋणात्मक परमाणु द्वारा अधिक आकर्षित होते हैं। इससे हाइड्रोजन परमाणु पर आंशिक धनावेश तथा दूसरे ऋणात्मक परमाणु पर आंशिक ऋणावेश आ जाता है। ऐसा धनावेशित हाइड्रोजन परमाणु दूसरे अणु के ऋणावेशित परमाणु के साथ एक क्षीण आबन्ध बनाता है। इस आबन्ध को ही हाइड्रोजन आबन्ध कहते हैं।
हाइड्रोजन बन्ध के प्रकार-हाइड्रोजन बन्ध दो प्रकार के होते हैं।
- अन्तरा-अणुक हाइड्रोजन बन्ध।
- अन्त:अणुक हाइड्रोजन बन्ध
हाइड्रोजन बन्ध की प्रकृति-हाइड्रोजन बन्ध की प्रकृति स्थिर विद्युत की तरह होती है। हाइड्रोजन बन्ध केवल वही तत्त्व बनाते हैं जिनकी परमाणु त्रिज्या छोटी तथा विद्युत ऋणात्मकता उच्च होती है। N, O, F ही केवल हाइड्रोजन बन्ध बनाते हैं क्योंकि इनकी विद्युत ऋणात्मकता ऊँची और परमाणु त्रिज्या छोटी होती है।
पदार्थों के भौतिक गुणों पर हाइड्रोजन बन्ध का प्रभाव
- अन्तरा-अणुक हाइड्रोजन बन्ध होने पर पदार्थ के गलनांक तथा क्वथनांक असामान्य रूप से बढ़ते हैं परन्तु अन्त:अणुक हाइड्रोजन बन्ध होने पर घटते हैं।
- अन्तरा-अणुक हाइड्रोजन बन्ध होने पर पदार्थ की विलेयता बढ़ती है परन्तु अन्त:अणुक होने पर विलेयता घटती है। (नोट-हाइड्रोजन बन्ध से किसी पदार्थ के केवल भौतिक गुण ही प्रभावित होते हैं रासायनिक गुण नहीं।)
एनसीईआरटी सोलूशन्स क्लास 11 रसायन विज्ञान पीडीएफ
- 1. रसायन विज्ञान की कुछ मूल अवधारणाएं
- 2. परमाणु की संरचना
- 3. तत्वों का वर्गीकरण तथा गुणधर्मो में आवर्तिता
- 5. द्रव्य की अवस्थाएं
- 6. ऊष्मागतिकी
- 7. साम्यावस्था
- 8. अपचयोपचय अभिक्रियाएँ
- 9. हाइड्रोजन
- 10. S - ब्लॉक के तत्व
- 11. P - ब्लॉक के तत्व
- 12. कार्बनिक रसायन - कुछ आधारभूत सिद्धांत तथा तकनीकें
- 13. हाइड्रोकार्बन
- 14. पर्यावरणीय रसायन