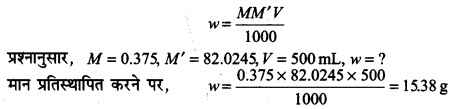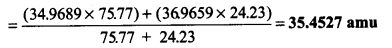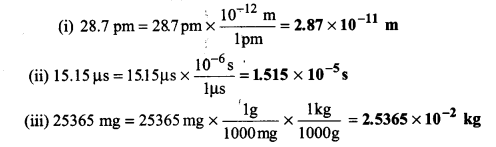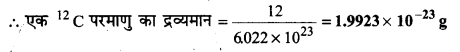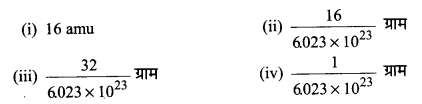NCERT Solutions Class 11 रसायन विज्ञान Chapter-1(रसायन विज्ञान की कुछ मूल अवधारणाएँ)
Class 11 (रसायन विज्ञान )
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
पाठ-1 (रसायन विज्ञान की कुछ मूल अवधारणाएँ)
अभ्यास के अ न्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
निम्नलिखित के लिए मोलर द्रव्यमान का परिकलन कीजिए-
(i) H20
(ii) CO2
(iii) CH4
उत्तर :
(i) H20 का मोलर द्रव्यमान = (2×1.008) + (1600) = 18.016 amu
(ii) CO2 का मोलर द्रव्यमान = 12.01+ (2×1600)= 44.01 amu
(iii) CH4, का मोलर द्रव्यमाने = 12.01+ (4×1.008)= 16.042 amu
प्रश्न 2.
सोडियम सल्फेट (Na2SO4) में उपस्थित विभिन्न तत्वों के द्रव्यमान प्रतिशत का परिकलन कीजिए।
उत्तर :
प्रश्न 3.
आयरन के उस ऑक्साइड का मूलनुपाती सूत्र ज्ञात कीजिए जिसमें द्रव्यमान द्वारा 69.9% आयरन और 30.1% ऑक्सीजन है।
उत्तर :
∴ मूलानुपाती सूत्रे =Fe203
प्रश्न 4.
प्राप्त कार्बन डाइऑक्साइड की मात्रा का परिकलन कीजिए। जब-
(i) 1 मोल कार्बन को हवा में जलाया जाता है और
(ii) 1 मोल कार्बन को 16 g ऑक्सीजन में जलाया जाता है।
उत्तर :
ऑक्सीजन/वायु में कार्बन निम्न प्रकार से जलता ह-
(i) हवा में ऑक्सीजन की प्रचुर मात्रा है। इस कारण से ज्वलन पूर्ण होता है। अतः 1 मोल कार्बन | के दहन से उत्पन्न CO2 = 44 g
(ii) इस स्थिति में ऑक्सीजन एक सीमांत अभिकर्मक है। केवल 0.5 मोल कार्बन के जलेंगे।
∴ 32 g ऑक्सीजन से उत्पन्न CO2 = 44g
∴ 16 g ऑक्सीजन से उत्पन्न CO2= = 22 g
प्रश्न 5.
सोडियम ऐसीटेट (CH3COONa) का 500 mL, 0.375 मोलर जलीय विलयन बनाने के लिए उसके कितने द्रव्यमान की आवश्यकता होगी? सोडियम ऐसीटेट का मोलर द्रव्यमान 82.0245 g mol-1 है।
उत्तर :
जलीय विलयन की मोलरता निम्न समीकरण से व्यक्त की जा सकती है-
अत: सोडियम ऐसीटेट के द्रव्यमान की आवश्यक मात्रा = 15.38 g
प्रश्न 6.
सान्द्र नाइट्रिक अम्ल के उस प्रतिदर्श का मोल प्रति लीटर में सान्द्रता का परिकलन कीजिए जिसमें उसका द्रव्यमान प्रतिशत 69% हो और जिसका घनत्व 1.41 g mL-1 हो।।
उत्तर :
दिया गया प्रतिदर्श 69% है अर्थात् 100 g विलयन में केवल 69 g नाइट्रिक अम्ल है। नाइट्रिक अम्ल का मोलर द्रव्यमान =1+14+ (3×16) = 63g mol-1
∴ 69 g शुद्ध नाइट्रिक अम्ल (जो विलयन के 100 g में उपस्थित है) में उपस्थित मोलों की संख्या =
प्रश्न 7.
100 g कॉपर सल्फेट (CuSO4) से कितना कॉपर प्राप्त किया जा सकता है?
उत्तर :
(CuSO4) का मोलर द्रव्यमान = 63.5 + 32+ (4×16)= 1595 g mol-1
1 मोल (159.5 g) (CuSO4) में Cu का 1 ग्राम परमाणु (63.5 g) उपस्थित रहता है
∴ 100 g कॉपर सल्फेट से प्राप्त कॉपर की मात्रा = = 39.81 g .
प्रश्न 8
आयरन के ऑक्साइड का आण्विक सूत्र ज्ञात कीजिए जिसमें आयरन तथा ऑक्सीजन का द्रव्यमान प्रतिशत क्रमशः 69.9 g तथा 30.1 g है।
उत्तर :
मूलानुपाती सूत्र की गणना के लिए प्रश्न 3 का हल देखिये।।
प्रश्न 9.
निम्नलिखित आँकड़ों के आधार पर क्लोरीन के औसत परमाणु द्रव्यमान का परिकलन कीजिए-
उत्तर :
क्लोरीन का औसत परमाणु द्रव्यमान
प्रश्न 10.
एथेन (C2H6) के तीन मोलों में निम्नलिखित का परिकलन कीजिए-
(i) कार्बन परमाणुओं के मोलों की संख्या
(ii) हाइड्रोजन परमाणुओं के मोलों की संख्या
(iii) एथेन के अणुओं की संख्या।
उत्तर :
1.1 मोल एथेन में कार्बन परमाणुओं के 2 मोल हैं।
∴ 3 मोल एथेन में उपस्थित कार्बन परमाणुओं के मोलों की संख्या = 3×2=6
2. 1 मोल एथेन में हाइड्रोजन परमाणुओं के 6 मोल हैं।
∴ 3 मोल एथेन में उपस्थित हाइड्रोजन परमाणुओं के मोलों की संख्या =3×6=18
3.1 मोल एथेन में उपस्थित अणु = 6.022×1023 (आवोगाद्रो संख्या)
∴ 3 मोल एथेन में उपस्थित अणुओं की संख्या = 3x 6.022x 1023 = 18.066×1023
प्रश्न 11.
यदि 20 g चीनी (C2H22O11) को जल की पर्याप्त मात्रा में घोलने पर उसका आयतन 2L हो जाए तो चीनी के इस विलयन की सान्द्रता क्या होगी?
उत्तर :
चीनी का मोलर द्रव्यमान = (12×12)+ (1×22) + (11×16) = 342 mol-1
प्रश्न 12.
यदि मेथेनॉल का घनत्व 0.793 kgL-1हो तो इसके 0.25 M के 2.5L विलयन को बनाने के लिए कितने आयतन की आवश्यकता होगी?
उत्तर :
मेथेनॉल का मोलर द्रव्यमान (CH3OH)= 32 g mol-1
दिये गये विलयन को तैयार करने के लिए आवश्यक मेथेनॉल का भार, जो निम्नवत् है-
अतः आवश्यक मेथेनॉल प्रतिदर्श का आयतन = 25.22 mL
प्रश्न 13.
दाब को प्रति इकाई क्षेत्रफल पर लगने वाले बल के रूप में परिभाषित किया जाता है। दाब का S.I. मात्रक पास्कल नीचे दिया गया है-
1 Pa=1Nm-2
यदि समुद्रतल पर हवा का द्रव्यमान 1034 g cm-2 हो तो पास्कल में दाब का परिकलन कीजिए।
उत्तर :
दाब को प्रति इकाई क्षेत्रफल पर लगने वाले बल के रूप में परिभाषित किया गया है।
समुद्रतल पर हवा का भार = mXg = 1034×98 = 10.1332 kg ms-2
प्रश्न 14.
द्रव्यमान का S.I. मात्रक क्या है? इसे किस प्रकार परिभाषित किया जाता है?
उत्तर :
द्रव्यमान का S.I. मात्रक किलोग्राम (kg) है। पेरिस के निकट सैवरेस में 0°C पर रखी प्लैटिनम-इरीडियम मिश्र-धातु की एक विशेष छड़ अथवा टुकड़े का द्रव्यमान 1 मानक किलोग्राम माना गया है।
प्रश्न 15.
निम्नलिखित पूर्व-लग्नों को उनके गुणांकों के साथ मिलाइए-
उत्तर :
- माइक्रो-10-6,
- डेका-10,
- मेगा–10°,
- गीगा–10,
- फेम्टो-10-15
प्रश्न 16.
सार्थक अंकों से आप क्या समझते हैं?
उत्तर :
उन अंकों की संख्या को, जिनके द्वारा किसी राशि को निश्चित रूप से व्यक्त किया जाता है. सार्थक अंक कहते हैं।
प्रश्न 17.
पेय जल के नमूने में क्लोरोफॉर्म, जो कैन्सरजन्य है, से अत्यधिक संदूषित पाया गया। संदूषण का स्तर 15 Ppm (द्रव्यमान के रूप में था।
(i) इसे द्रव्यमान प्रतिशतता में दर्शाइए।
(ii) जल के नमूने में क्लोरोफॉर्म की मोललता ज्ञात कीजिए।
उत्तर :
(i) 15 Ppm (द्रव्यमान द्वारा) का अर्थ है कि क्लोरोफॉर्म के 15 भाग (द्रव्यमान से) पानी के 106 भाग (द्रव्यमान से) में उपस्थित हैं।
प्रश्न 18.
निम्नलिखित को वैज्ञानिक संकेतन में लिखिए-
(i) 0.0048
(ii) 234.000
(iii) 8008
(iv) 500.0
(v) 6.0012
उत्तर :
(i) 4.8×10-3,
(ii) 234×105,
(iii) 8.008×103,
(iv) 5.000×102,
(v) 60012×100
प्रश्न 19.
निम्नलिखित में सार्थक अंकों की संख्या बताइए-
(i) 0.0025
(ii) 208
(iii) 5005
(iv) 126,000
(v) 500.00
(vi) 2.0034
उत्तर :
(i) 2,
(ii) 3,
(iii) 4,
(iv) 6,
(v) 3,
(vi) 5
प्रश्न 20.
निम्नलिखित को तीन सार्थक अंकों तक निकटित कीजिए-
(i) 34.216
(ii) 10.4107
(iii) 0.04597
(iv) 2808
उत्तर :
(i) 34.2,
(ii) 10.4,
(iii) 0.0460,
(iv) 2810
प्रश्न 21.
(क) जब डाइनाइट्रोजन और डाइऑक्सीजन अभिक्रिया द्वारा भिन्न यौगिक बनाती हैं। तो निम्नलिखित आँकड़े प्राप्त होते हैं-
ये प्रायोगिक आँकड़े रासायनिक संयोजन के किस नियम के अनुरूप हैं? बताइए।
(ख) निम्नलिखित में रिक्त स्थान को भरिए-
उत्तर :
(क) यदि नाइट्रोजन का द्रव्यमान 28 g स्थिर माना जाये तो इन चारों स्थितियों में ऑक्सीजन का द्रव्यमान क्रमशः 32 g, 64 g, 32 g और 80 g प्राप्त होता है, जो सरल पूर्ण संख्या अनुपात । 2 : 4 : 2 : 5 में हैं। अतः दिये गये आँकड़े गुणित अनुपात के नियम का पालन करते हैं।
प्रश्न 22.
यदि प्रकाश का वेग 3.00 x 108 ms-1 हो तो 2.00 ns में प्रकाश कितनी दूरी तय करेगा?
उत्तर :
तय दूरी = वेग x समय = 30×108 ms-1x200 ns
= 3.0×108 ms-1x200nsx= 6.00×10-1m=0.600 m
प्रश्न 23.
किसी अभिक्रिया A+B2→AB, में निम्नलिखित अभिक्रिया मिश्रणों में सीमान्त अभिकर्मक, (यदि कोई हो तो) ज्ञात कीजिए-
(i) A के 300 परमाणु + B के 200 अणु
(ii) 2 मोल A+3 मोल B
(iii) A के 100 परमाणु + B के 100 अणु
(iv) A के 5 मोल + B के 2-5 मोल
(v) A के 25 मोल+ B के 5 मोल
उत्तर :
- दी गई अभिक्रिया के अनुसार, A + B2 → AB2 A का एक परमाणु AB के एक अणु से अभिक्रिया करता है।∴ पूर्ण अभिक्रिया में A के 300 परमाणुओं के लिए, B के 300 अणुओं की आवश्यकता होगी। क्योंकि B के केवल 200 अणु उपस्थित हैं, अतः 100 अणुओं की कमी है। इस प्रकार A अधिकता में है। इसलिए B एक सीमान्त अभिकर्मक है।
- A के 1 मोल, B के 1 मोल से अभिक्रिया करते हैं।∴ A के 2 मोल, B के 2 मोल से अभिक्रिया करेंगे B के 3 मोल उपस्थित हैं जो अधिकता में हैं। इस प्रकार A एक सीमान्त अभिकर्मक है।
- A के 100 परमाणु B के 100 अणुओं से पूरी तरह अभिक्रिया करेंगे। इस प्रकार दोनों प्रयुक्त हो जायेंगे। अत: इस स्थिति में कोई सीमान्त अभिकर्मक नहीं होगा।
- B के 2.5 मोल, A के 2.5 मोल के साथ अभिक्रिया करेंगे। इस प्रकार A अधिकता में बचा रहेगा। अतः, B एक सीमान्त अभिकर्मक है।
- A के 2.5 मोल B के 2.5 मोल के साथ अभिक्रिया करेंगे। इस प्रकारे B अधिकता में बचा रहेगा। अतः A एक सीमान्त अभिकर्मक है।
प्रश्न 24.
डाइनाइट्रोजन और डाइहाइड्रोजन निम्नलिखित रासायनिक समीकरण के अनुसार अमोनिया बनाती हैं-
N2(g) + 3H2(g) → 2NH3(g)
(i) यदि 2-00×103g डाइनाइट्रोजन 1-00×103 g डाइहाइड्रोजन के साथ अभिक्रिया करती है तो प्राप्त अमोनिया के द्रव्यमान का परिकलन कीजिए।
(ii) क्या दोनों में से कोई अभिकर्मक शेष बचेगा?
(iii) यदि हाँ, तो कौन-सा उसका द्रव्यमान क्या होगा?
उत्तर :
स्पष्ट है, डाइहाइड्रोजन अधिकता में है तथा डाइनाइट्रोजन एक सीमान्त अभिकर्मक है।
∵ 28 g डाइनाइट्रोजन से उत्पन्न अमोनिया = 34g
(ii) डाइहाइड्रोजन शेष बचेगा।
(iii) शेष H, का द्रव्यमान = 1.00×10-3 – 428.57=571.43 g
प्रश्न 25.
0.5 मोल Na2CO3और 0.50 M Na2CO3 में क्या अन्तर है?
उत्तर :
Na2CO3 का मोलर द्रव्यमान = (2×23) +12+ (3×16)= 106
0.5 मोल 2CO3 से तात्पर्य है-
05×106= 53g Na2CO3
यह केवल द्रव्यमान को सन्दर्भित करता है।
0.50 M Na2CO3 से तात्पर्य है 0.50 मोलर, अर्थात् Na2CO3 के 53 gm 1 लीटर विलयन में उपस्थित हैं। इस प्रकार यह विलयन के सान्द्रण को बताता है।
प्रश्न 26.
यदि डाइहाइड्रोजन गैस के 10 आयतन डाइऑक्सीजन गैस के 5 आयतनों के साथ अभिक्रिया करें तो जलवाष्प के कितने आयतन प्राप्त होंगे?
उत्तर :
हाइड्रोजन (H2) के दो आयतन ऑक्सीजन (O2) के एक आयतन के साथ अभिक्रिया करके जल वाष्प (H20) के दो आयतन उत्पन्न करते हैं।
इस प्रकार H2 के 10 आयतन पूर्णत: O2, के 5 आयतन के साथ अभिक्रिया करके जलवाष्प के 10 आयतन उत्पन्न करेंगे।
प्रश्न 27.
निम्नलिखित को मूल मात्रकों में परिवर्तित कीजिए-
(i) 28.7 pm
(ii) 15.15 us
(iii) 25365 mg
उत्तर :
प्रश्न 28.
निम्नलिखित में से किसमें परमाणुओं की संख्या सबसे अधिक होगी?
(i) 1g Au(s)
(ii) 1 g Na(s)
(iii) 1g Li(s)
(iv) 1 g Cl2(g)
उत्तर :
इस प्रकार एक ग्राम लीथियम में परमाणुओं की संख्या सबसे अधिक है।
प्रश्न 29.
एथेनॉल के ऐसे जलीय विलयन की मोलरता ज्ञात कीजिए जिसमें एथेनॉल का मोल-अंश 0.040 है।
उत्तर :
इस प्रकार एक लीटर विलयन में एथेनॉल के 2.314 मोल उपस्थित हैं। अत: दिये गये विलयन की मोलरता = 2.314 M
प्रश्न 30.
एक 12c कार्बन परमाणु का ग्राम (g) में द्रव्यमान क्या होगा?
उत्तर :
12c के एक मोल अर्थात् 6.022×1023 परमाणुओं का द्रव्यमान 12g होता है।
प्रश्न 31.
निम्नलिखित परिकलनों के उत्तर में कितने सार्थक अंक होने चाहिए?
(i)
(ii) 5×5.364
(iii) 0.0125 + 0.7864 + 0.0215
उत्तर :
(i) न्यूनतम यथार्थ परक संख्या (0.112) में तीन सार्थक अंक हैं। अत: उत्तर में तीन सार्थक अंक होने चाहिए।
(ii) पाँच पूर्ण संख्या हैं। दूसरी संख्या अर्थात् 5.364 में 4 सार्थक अंक है। अत: उत्तर में चार सार्थक अंक होने चाहिए।
(iii) उत्तर में चार सार्थक अंक होने चाहिए क्योंकि दशमलव स्थानों की न्यूनतम संख्या 4 है।
प्रश्न 32.
प्रकृति में उपलब्ध ऑर्गन के मोलर द्रव्यमान की गणना के लिए निम्नलिखित तालिका में-
उत्तर :
ऑर्गन का औसत मोलर द्रव्यमान
प्रश्न 33.
निम्नलिखित में से प्रत्येक में परमाणुओं की संख्या ज्ञात कीजिए-
(i) 52 मोल Ar
(ii) 52u He
(iii) 52 g He
उत्तर :
(i) ऑर्गन का 1 मोल= 6.022×1023परमाणु
∴ ऑर्गन के 52 मोल= 52x 6.022×1023 परमाणु = 3.131×1025 परमाणु
(ii) He के 4u = He का एक परमाणु
∴ He के 52u = = 13 परमाणु
(iii) He के एक मोल अर्थात् इसके 4 g में 6.022×103 परमाणु उपस्थित होते हैं।
अतः 52 g He में उपस्थित परमाणुओं की संख्या =
= 3.131×1025 परमाणु
प्रश्न 34.
एक वेल्डिंग ईंधन गैस में केवल कार्बन और हाइड्रोजन उपस्थित हैं। इसके नमूने की कुछ मात्रा ऑक्सीजन से जलाने पर 3.38 g कार्बन डाइऑक्साइड, 0.690 g जल के अतिरिक्त और कोई उत्पाद नहीं बनाती। इस गैस के 10.0L (STP पर मापित) आयतन का द्रव्यमान 11.69 g पाया गया। इसके-
(i) मूलानुपाती सूत्र
(ii) अणु द्रव्यमान और
(iii) अणुसूत्र की गणना कीजिए।
उत्तर :
प्रश्न 35.
CaCO3 जलीय HCI के साथ निम्नलिखित अभिक्रिया कर CaCI2 और C02 बनाता है।
CaC03(s) + 2HCI(g) → CaCl2(aq) + C02(g) + H2O(l) 0.75 M-HCI के 25 mL के साथ पूर्णतः अभिक्रिया करने के लिए CaCO3 की कितनी मात्रा की आवश्यकता होगी?
उत्तर :
विलयन की मोलरता (M) निम्न सम्बन्ध से प्राप्त की जा सकती है-
प्रश्न 36.
प्रयोगशाला में क्लोरीन का विरचन मैंगनीज डाइऑक्साइड (MnO2) की जलीय HCI विलयन के साथ अभिक्रिया द्वारा निम्नलिखित समीकरण के अनुसार किया जाता है| 4HCI(aq) + MnO2(s) → 2H20(l) + MnCl2(aq) + Cl2(g)
5.0 g मैंगनीज डाइऑक्साइड के साथ HCI के कितने ग्राम अभिक्रिया करेंगे?
उत्तर :
दी गई समीकरण निम्नवत् है-
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
जल तथा हाइड्रोजन परॉक्साइड निम्नलिखित में कौन-सा नियम दर्शाते हैं?
(i) स्थिर अनुपात का नियम
(ii) व्युत्क्रमानुपाती नियम ।
(iii) रासायनिक तुल्यता का नियम
(iv) गुणित अनुपात का नियम
उत्तर :
(iv) गुणित अनुपात का नियम
प्रश्न 2.
आवोगाद्रो संख्या अणुओं की वह संख्या है जो उपस्थित रहती है।
(i) NTP पर 22.4 ली गैस में
(ii) किसी पदार्थ के 1 मोल में
(iii) पदार्थ के 1 ग्राम अणुभार
(iv) ये सभी
उत्तर :
(iv) ये सभी
प्रश्न 3.
1 परमाण्विक द्रव्यमान इकाई (amu) का मान होता है।
(i)127 MeV
(ii) 9310 MeV
(iii) 931 MeV
(iv) 937 MeV
उत्तर :
(iii) 931 Mev
प्रश्न 4.
1.12 लीटर नाइट्रोजन का STP पर लगभग द्रव्यमान है।
(i) 0.7 ग्राम
(ii) 2.8 ग्राम
(iii) 1.4 ग्राम
(iv) 3.0 ग्राम
उत्तर :
(iii) 1.4 ग्राम
प्रश्न 5.
ऑक्सीजन के एक परमाणु का भार होगा
उत्तर :
(ii) ग्राम
प्रश्न 6.
किसी गैस के 0.1 ग्राम का NTP पर आयतन 28 मिली है। इस गैस का अणुभार है
(i) 56
(ii) 40
(iii) 80
(iv) 60
उत्तर :
(iii) 80
प्रश्न 7.
7.1 ग्राम क्लोरीन गैस में क्लोरीन के मोलों की संख्या है।
(i) 0.01
(ii) 0.1
(iii) 0.05
(iv) 0.5
उत्तर :
(ii) 0.1
प्रश्न 8.
निम्न में से सबसे अधिक नाइंट्रोजन परमाणुओं की संख्या किसमें है?
(i)NH4CI का 1 मोल,
(ii) 2M NH3 का 500 मिली।
(iii) NO2 के 6023 X 1023 अणु
(iv) NTP पर 22.4 लीटर N2 गैस
उत्तर :
(iv) NTP पर 22.4 लीटर N2गैस
प्रश्न 9.
निम्नलिखित में अधिकतम अणुओं की संख्या किसमें है?
(i) 44 ग्राम CO2 में
(ii) 48 ग्राम O3 में
(iii) 8 ग्राम H2में
(iv) 64 ग्राम SO2 में
उत्तर :
(iii) 8 ग्राम H2 में
प्रश्न 10.
अणुओं की संख्या सर्वाधिक है।
(i) STP पर 15 लीटर H2 गैस में
(ii) STP पर 5 लीटर N2 गैस में
(iii) 0.5 ग्राम H2 गैस में,
(iv) 10 ग्राम O2 गैस में
उत्तर :
(i) STP पर 15 लीटर H2 गैस में
प्रश्न 11.
10 M-HCI के 100 मिली को 10 M- Na2CO3 के 75 मिली के साथ मिलाया गया।
परिणामी विलयन होगा
(i) अम्लीय
(ii) क्षारीय
(iii) उभयधर्मी
(iv) उदासीन
उत्तर :
(ii) क्षारीय
प्रश्न 12.
पानी में H :0 को भारात्मक अनुपात है।
(i) 1:1
(ii) 1:2
(iii) 1 : 8
(iv) 1: 16
उत्तर :
(iii) 1 : 18
प्रश्न 13.
आसुत (distilled) जल की मोलरता है
(i) 55.56
(ii) 18.00
(iii) 49.87
(iv) 81.00
उत्तर :
(i) 55.56
प्रश्न 14.
यूरिया के जलीय विलयन की मोललता 4.44 मोल/किग्रा है। विलयन में यूरिया का मोल प्रभाज है।
(i) 0.074
(ii) 0.00133
(iii) 0.008
(iv) 0.0044
उत्तर :
(i) 0.074
प्रश्न 15.
H3PO4 के 1 M विलयन की नॉर्मलता है।
(i) 0.5 N
(ii) 1N
(iii) 2 N
(iv) 3 N
उत्तर :
(iv) 3 N
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
दो तत्वों के नाम लिखिए जो उपधातुओं के रूप में कार्य करते हैं।
उत्तर :
आर्सेनिक व ऐण्टीमनी।
प्रश्न 2.
सेल्सियस तथा फारेनहाइट में सम्बन्ध बताइए।
उत्तर :
सेल्सियस तथा फारेनहाइट में सम्बन्ध इस प्रकार है : °F = (°C)+32
प्रश्न 3.
स्थिर अनुपात का नियम किस वैज्ञानिक ने दिया था?
उत्तर :
स्थिर अनुपात का नियम फ्रांसीसी रसायनज्ञ जोसफ प्राउस्ट ने सन् 1779 में दिया था।
प्रश्न 4.
कौन-सा नियम गैसीय अभिकारकों तथा गैसीय उत्पादों के अनुपात से सम्बन्धित है?
उत्तर :
गै-लुसैक का नियम गैसीय अभिकारकों तथा गैसीय उत्पादों के अनुपात से सम्बन्धित है।
प्रश्न 5.
1 मोल पदार्थ को परिभाषित कीजिए।
उत्तर :
मोल पदार्थ की मात्रा का मात्रक है। 1 मोल पदार्थ की वह मात्रा है जिसमें उतने ही मूल कण होते हैं जितने की 0.012 किग्रा कार्बन-12 में परमाणु होते हैं।
प्रश्न 6.
CaCO3 के 20 ग्राम में मोलों की संख्या की गणना कीजिए।
उत्तर :
प्रश्न 7.
4.4 ग्राम CO2 में ऑक्सीजन परमाणुओं की संख्या क्या होगी?
उत्तर :
4.4 ग्राम CO2 में मोलों की संख्या = = 0.1 मोल
0.1 मोल CO2 में ऑक्सीजन परमाणुओं की संख्या
= 01x2xN = 01x2x 6023×1023
=1.2046×1023
प्रश्न 8.
C12 के 12 ग्राम में परमाणुओं की संख्या की गणना कीजिए।
उत्तर :
C12 के मोलों की संख्या = = 0.1 मोल
अतः 1 मोल C12 में परमाणुओं की संख्या = 6.023×1023 C12 परमाणु
प्रश्न 9.
CaCl2.2H2O का प्रतिशत संघटन निकालिए।
[Ca = 40, CI= 35.5, H = 1, 0 = 16]
उत्तर :
प्रश्न 10.
मूलानुपाती सूत्र से आप क्या समझते हैं?
उत्तर :
वह सूत्र जो किसी यौगिक के अणु में उपस्थित विभिन्न परमाणुओं के सरलतम पूर्ण संख्या अनुपात को दर्शाता है, यौगिक का मूलानुपाती सूत्र कहलाता है।
प्रश्न 11.
मूलानुपाती सूत्र तथा आणविक सूत्र में सम्बन्ध बताइए।
उत्तर :
आणविक सूत्र = nx मूलानुपाती सूत्र (जहाँ ॥ = 1, 2, 3, 4, 5,……..)
प्रश्न 12.
स्टॉइकियोमीट्रिक (रससमीकरणमिती) गुणांक क्या है?
2KCIO3 → 2KCl+3O2
अभिक्रिया के लिए स्टॉइकियोमीट्रिक गुणांक लिखिए।
उत्तर :
स्टॉइकियोमीट्रिक गुणांक सन्तुलित रासायनिक समीकरण में अभिकारकों तथा उत्पादों के मोलों की संख्या को स्टॉइकियोमीट्रिक गुणांक कहते हैं।
2KCIO3 → 2KCl+3O2
उपर्युक्त अभिक्रिया में KCIO3 के 2 मोल गर्म करने पर 2 मोल KCI तथा 3 मोल 0, उत्पन्न हो रहा है। अतः उपर्युक्त अभिक्रिया का स्टॉइकियोमीट्रिक गुणांक 2, 2 व 3 है।
प्रश्न 13.
स्टॉइकियोमीट्रिक तथा अन-स्टॉइकियोमीट्रिक यौगिकों में अन्तर बताइए।
उत्तर :
वे यौगिक जिनमें विद्यमान तत्वों का संघटन निश्चित होता है, स्टॉइकियोमीट्रिक कहलाते हैं; जैसे-H20, NH3 CH4, CO2 आदि। जबकि वे यौगिक जिनमें विद्यमान तत्वों का संघटन संयोग करने वाले अवयवों की संयोजकताओं के अनुरूप नहीं होता है तथा परिवर्तनीय होता है, जैसे-अन-स्टॉइकियोमीट्रिक कहलाते हैं; ; Fe0.98O, Cu1.7S आदि।
प्रश्न 14.
रासायनिक अभिक्रिया की परिभाषा एवं प्रकार लिखिए।
उत्तर :
रासायनिक अभिक्रिया रसायन विज्ञान में विभिन्न रसायनों की एक-दूसरे से होने वाली अभिक्रिया रासायनिक अभिक्रिया कहलाती है। किसी रासायनिक अभिक्रिया में भाग लेने वाले पदार्थों को अभिकारक तथा उस अभिक्रिया में बनने वाले पदार्थों को उत्पाद कहते हैं। रासायनिक अभिक्रियाएँ मुख्यतः निम्न प्रकार की होती हैं।
- अम्ल-क्षार अभिक्रियाएँ
- ऑक्सीकारक-अपचयन अभिक्रियाएँ
- अवक्षेपण अभिक्रियाएँ
प्रश्न 15.
मोल प्रभाज को संक्षेप में परिभाषित कीजिए।
उत्तर :
मोल प्रभाज “विलयन में उपस्थित किसी एक अवयव का मोल प्रभाज उस विलयन में उपस्थित उस अवंयव के मोलों (ग्राम-अणुओं) की संख्या तथा विलयन में उपस्थित इन सभी अवयवों के मोलों की कुल संख्या का अनुपात होता है।”
[नोट : विलयन में उपस्थित सभी अवयवों के मोल प्रभाज का योग सदैव एक होता है तथा अवयवों के मोल प्रभाज ताप परिवर्तन पर अपरिवर्तित रहते हैं।
प्रश्न 16.
विलयन की मोलरता क्या व्यक्त करती है?
उत्तर :
किसी विलयन के एक लीटर आयतन में उपस्थित विलेय पदार्थ के मोलों की संख्या को उस विलयन की मोलरता कहते हैं। इस प्रकार यह विलयन के प्रति लीटर में विलेय की सान्द्रता व्यक्त करती है।
प्रश्न 17.
मोललता की परिभाषा लिखिए तथा इसकी इकाई भी बताइए।
उत्तर :
किसी विलायक के 1 किग्रा में उपस्थित विलेय के मोलों की संख्या मोललता कहलाती है। इसे m से निरूपित करते हैं।
इसकी इकाई (मात्रक) मोल/किग्रा है।
लघु उत्तरीय प्रश्न
प्रश्न 1.
निम्नलिखित को परिभाषित कीजिए
(i) द्रव्य,
(ii) तत्त्व,
(iii) यौगिक,
(iv) मिश्रण,
(v) परमाणु तथा
(vi) अणु
उत्तर :
- द्रव्य-वह पदार्थ जो स्थान घेरता है, जिसमें भार होता है तथा जिसका ज्ञान हम अपनी ज्ञानेन्द्रियों द्वारा कर सकते हैं, द्रव्य कहलाता है।
- तत्त्व-ऐसे द्रव्य जिनको किसी भी विधि द्वारा दो या दो से अधिक विभिन्न द्रव्यों में अपघटित न किया जा सके, तत्त्व कहलाते हैं। उदाहरणार्थ-लोहा, ताँबा, चाँदी आदि।
- यौगिक–शुद्ध समांगी द्रव्य (पदार्थ) जो दो या दो से अधिक तत्त्वों के निश्चित अनुपात में पारस्परिक रासायनिक संयोग से बनता है, यौगिक कहलाता है। उदाहरणार्थ-सोडियम क्लोराइड, चीनी, जल आदि।
- मिश्रण–वे द्रव्य जो दो या दो से अधिक पदार्थों (तत्त्वों अथवा यौगिकों) को किसी भी अनुपात में मिला देने पर बनते हैं, मिश्रण कहलाते हैं। उदाहरणार्थ-चीनी और रेत का मिश्रण, चीनी का जल में मिश्रण आदि।
- परमाणु-तत्त्व का वह सूक्ष्मतम कण जो रासायनिक अभिक्रिया में भाग ले सकता है, परमाणु कहलाता है।
- अणु-किसी पदार्थ (तत्त्व अथवा यौगिक) का वह सूक्ष्मतम कण जो स्वतन्त्र रूप में रह सकता है, अणु कहलाता है।
प्रश्न 2.
मिश्रण और यौगिक में अन्तर बताइए।
उत्तर :
मिश्रण और यौगिक में अन्तर निम्नलिखित हैं-
प्रश्न 3.
द्रव्य की कणिक प्रकृति पर टिप्पणी लिखिए।
उत्तर :
हम जानते हैं कि सभी भौतिक वस्तुएँ द्रव्य से बनी हुई हैं परन्तु द्रव्य किससे बना हुआ है? इस प्रश्न का उत्तर मानव प्राचीनकाल से ही खोजता आया है। ईसा से 500 वर्ष पूर्व भारतीय महर्षि कणाद ने यह विचार व्यक्त किया था कि द्रव्य असतत हैं अर्थात् द्रव्य अतिसूक्ष्म अभिकारक कणों से बना हुआ है। ईसा से पूर्व पाँचवीं शताब्दी में यूनानी दार्शनिक डेमोक्रेटस ने तथा ईसा से पूर्व प्रथम शताब्दी में रोम के दार्शनिक ल्यूक्रिटस ने भी यही विचार व्यक्त किये थे कि द्रव्य अतिसूक्ष्म अविभाज्य कणों से बना हुआ है। इस प्रकार यह सिद्ध हुआ कि द्रव्य की प्रकृति कणिक होती है। 17 वीं और 18 वीं शताब्दी में भी कुछ रसायनशास्त्रियों ने द्रव्य की कणिक प्रकृति सम्बन्धी परिकल्पनाएँ दी। परन्तु 19 वीं शताब्दी से पूर्व तक द्रव्य की रचना के सम्बन्ध में व्यक्त किये गये विचार केवल सपना मात्र थे। सन् 1803 में जॉन डॉल्टन ने सर्वप्रथम परमाणु परिकल्पना के आधार पर द्रव्य की कणिक प्रकृति को सिद्ध किया। अभी यह परमाणु परिकल्पना प्रयोगों और प्रेक्षणों के परिणामों पर आधारित थी। इस प्रकार सिद्ध हुआ कि द्रव्य की प्रकृति कृणिक होती है अर्थात् यह अविन्यास कणों (परमाणुओं) से निर्मित होता है।
प्रश्न 4.
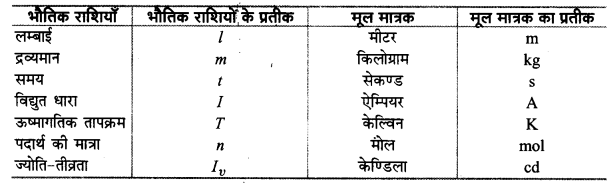
S.I. पद्धति के मूल मात्रक कौन-कौन से हैं? ये किन भौतिक राशियों से सम्बन्धित हैं?
उत्तर :
S.I. पद्धति के मूल मात्रक, उनसे संम्बन्धित भौतिक राशियों तथा उनके प्रतीकों को निम्नांकित सारणी में दर्शाया गया है-
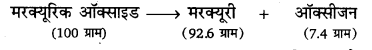
प्रश्न 5.
द्रव्यमान संरक्षण का नियम क्या है? एक प्रयोग द्वारा दर्शाइए कि रासायनिक परिवर्तन के लिए भी यह नियम सत्य है।
उत्तर :
इस नियम के अनुसार, “किसी रासायनिक अथवा भौतिक परिवर्तन में, उत्पादों का कुल द्रव्यमान अभिकारकों के कुल द्रव्यमान के बराबर होता है। प्रयोग जब 100 ग्राम मरक्यूरिक ऑक्साइड को एक बन्द नली में लेकर गर्म किया जाता है तो 92.6 ग्राम मरक्यूरी और 7.4 ग्राम ऑक्सीजन प्राप्त होती है।
यहाँ उत्पादों का कुल द्रव्यमान (92.6 ग्राम + 7.4 ग्राम = 100 ग्राम) अभिकारक के द्रव्यमान (100 ग्राम) के बराबर है।।
प्रश्न 6.
स्थिर अनुपात के नियम को एक उदाहरण द्वारा समझाइए।
उत्तर :
इस नियम के अनुसार, “एक रासायनिक यौगिक में एक ही प्रकार के तत्त्व भारानुसार एक निश्चित अनुपात में जुड़े रहते हैं।’ उदाहरणार्थ— कार्बन डाइऑक्साइड किसी भी विधि से बनाई जाए (वायु में कोयले को गर्म करके, सोडियम बाइकार्बोनेट को गर्म करके अथवा कैल्सियम कार्बोनेट को गर्म करके) उसमें सदैव 1 कार्बन परमाणु और 2 ऑक्सीजन परमाणु होते हैं तथा ये दोनों सदैव भारानुसार 12 : 32 अथवा 3: 8 के अनुपात में जुड़े रहते हैं।
प्रश्न 7.
गुणित अनुपात के नियम को एक उदाहरण द्वारा समझाइए।
उत्तर :
इस नियम के अनुसार, “जब दो तत्त्वे परस्पर संयोग करके एक से अधिक यौगिक बनाते हैं, तब उनमें एक तत्त्व के विभिन्न भार जो दूसरे तत्त्व के एक निश्चित भार से संयोग करते हैं परस्पर सरल अनुपात में होते हैं। उदाहरणार्थ-सल्फर, ऑक्सीजन के साथ संयोग करके दो यौगिक सल्फर डाइऑक्साइड और सल्फर ट्राइऑक्साइड बनाता है। सल्फर डाइऑक्साइड में सल्फर के 32 भाग, ऑक्सीजन के 32 भागों (भारानुसार) से संयोग करते हैं जबकि सल्फर ट्राइऑक्साइड में सल्फर के 32 भाग ऑक्सीजन के 48 भागों (भारानुसार) से संयोग करते हैं। ऑक्सीजन के विभिन्न भारों, जो सल्फर के निश्चित भार (32 भाग) से संयोग करते हैं, का अनुपात 32:48 अथवा 2:3 हैं जो कि एक सरल अनुपात हैं।
प्रश्न 8.
व्युत्क्रम अनुपात के नियम को एक उदाहरण द्वारा समझाइए।
उत्तर :
इस नियम के अनुसार, “जब दो तत्त्व किसी तीसरे तत्त्व के निश्चित भार से संयोग करते हैं, तो उनके भारों का अनुपात या तो वही रहता है या उन भारों के अनुपात का अपवर्त्य होता है जिसमें वे आपस में संयोग करते हैं। उदाहरणार्थ-कार्बन, सल्फर और ऑक्सीजन तीन तत्त्व हैं। कार्बन और सल्फर ऑक्सीजन से अलग-अलग संयोग करके क्रमशः कार्बन डाइऑक्साइड और सल्फर डाइऑक्साइड बनाते हैं। सल्फर और कार्बन आपस में संयोग करके कार्बन डाइसल्फाइड बनाते हैं। कांर्बन डाइऑक्साइड (CO, ) में कार्बन के 12 भाग ऑक्सीजन के 32 भागों से संयोग (भारानुसार) करते हैं जबकि सल्फर डाइऑक्साइड (SO,) में सल्फर के 32 भाग ऑक्सीजन के 32 भागों से संयोग (भारानुसार) करते हैं। अब ऑक्सीजन के निश्चित भार (32 भाग) से संयोग करने वाले कार्बन और सल्फर के भारों में अनुपात 12 : 32 अथवा 3 : 8 कार्बन डाइसल्फाइड (Cs,) में कार्बन के 12 भाग सल्फर के 64 भागों से संयोग (भारानुसार) करते हैं। CS, में कार्बन और सल्फर के भारों में अनुपात 12:64 अथवा 3 : 16
ऊपर दिए गए अनुपातों में अनुपात अथवा 2 : 1.
अत: ऑक्सीजन के निश्चित भार के साथ संयोग करने वाले कार्बन और सल्फर के भारों में अनुपात, भारों के उस अनुपात का सरल अपवर्त्य होता है जिसमें कार्बन और सल्फर आपस में संयोग करते हैं। इस प्रकार यह उदाहरण व्युत्क्रम अनुपात के नियम की पुष्टि करता है।
प्रश्न 9.
गै-लुसैक के नियम को एक उदाहरण द्वारा समझाइए।
उत्तर :
इस नियम के अनुसार, “जब दो गैसें परस्पर संयोग या रासायनिक अभिक्रिया करती हैं, तो समान ताप व दाब पर अभिकारक तथा उत्पाद गैसों के आयतन सरल अनुपात में होते हैं।’
उदाहरणार्थ -एक आयतन हाइड्रोजन (H2), एक आयतन क्लोरीन (Cl2) के साथ संयोग करके 2 आयतन हाइड्रोजन क्लोराइड गैस (HCI) देती है।
अत: अभिकारक तथा उत्पाद गैसों का अनुपात 1: 1 : 2 है।
प्रश्न 10.
42.47 ग्राम सिल्वर नाइट्रेट प्रति लीटर वाले विलयन के 10 मिली से कितने ग्राम सिल्वर क्लोराइड प्राप्त होगी? (Ag = 108, N=14, 0 = 16, Cl= 35.5, H = 1)
उत्तर :
प्रश्न 11.
सामान्य ताप एवं दाब पर 2.4 लीटर ऑक्सीजन प्राप्त करने के लिए कितना KCIO3आवश्यक है? (K= 39, Cl= 35.5)
उत्तर :
प्रश्न 12.
1.7 ग्राम अमोनिया (अणुभार = 17) में मोलों और अणुओं की संख्या ज्ञात कीजिए।
उत्तर :
प्रश्न 13.
1 ग्राम हीलियम (He) में परमाणुओं की संख्या और NTP पर आयतन की गणना कीजिए।
उत्तर :
विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
मानव जीवन में रसायन विज्ञान के महत्व एवं विस्तार का वर्णन कीजिए।
उत्तर :
आधुनिक जीवन में रसायन विज्ञान का बहुत महत्त्वपूर्ण स्थान है। यह लगभग सभी क्षेत्रों में मानव-समाज की सेवा कर रहा है और मानव जीवन को सुखी, स्वस्थ, सुरक्षित एवं समृद्ध बना रहा है। राष्ट्रीय अर्थ-व्यवस्था में भी रसायन विज्ञान का महत्त्वपूर्ण योगदान है। देश की विकास योजनाओं की सफलत बहुत कुछ रसायन-विज्ञान के अनुप्रयोग पर निर्भर करती है। सभी लघु और बड़े उद्योगों में रासायनिक पदार्थों की आवश्यकता पड़ती है। अम्ल, क्षार और लवणों का उपयोग धातु-निष्कर्षण, धातु-शोधन, पेट्रोलियम शोधन तथा काँच, साबुन, कागज, कपड़ा, उर्वरक, विस्फोटक, रंजक, औषधियों आदि के उत्पादन में होता है। सल्फ्यूरिक अम्ल, नाइट्रिक अम्ल, अमोनिया, कॉस्टिक सोडा और क्लोरीन उद्योगों के स्तम्भ हैं। लोहा, ताँबा, ऐलुमिनियम, जिंक, निकिल आदि धातुओं, पीतल तथा स्टील अनेक प्रकार की मिश्र-धातुओं का उपयोग उद्योग-धन्धों और दैनिक जीवन की अनेकों वस्तुएँ बनाने में होता है। प्लास्टिक, टेफ्लॉन, पॉलिथीन, कृत्रिम रबर व अन्य बउत्तरकों से अनेक प्रकार की उपयोगी वस्तुएँ बनाई जाती हैं। कृत्रिम रेशम, ऊन तथा धागों से वस्त्र बनाए जाते हैं। कीटनाशी, पीड़कनाशी आदि रसायन फसल की रक्षा करते हैं। औषधियाँ स्वास्थ्य तथा जीवन की रक्षा करती हैं। तेल, वसा, प्रोटीन, कार्बोहाइड्रेट, लवण और विटामिन हमारे भोजन के आवश्यक अंग हैं। संक्षेप में रसायन विज्ञान के महत्त्व को निम्नवत् स्पष्ट किया जा सकता है-
प्रश्न 2.
डाल्टन का परमाणु सिद्धान्त क्या है? इसके प्रमुख बिन्दु लिखिए। इसके दोषों का भी वर्णन कीजिए।
उत्तर :
डोल्टन का परमाणु सिद्धान्त-एक अंग्रेज अध्यापक जॉन डाल्टन ने सन् 1808 में द्रव्य की रचना के सम्बन्ध में एक सिद्धान्त का प्रतिपादन किया जिसे डाल्टन का परमाणु सिद्धान्त कहते हैं। इस परमाणु सिद्धान्त के प्रमुख बिन्दु निम्नवत् हैं-
- द्रव्य अत्यन्त सूक्ष्म अविभाज्य कणों का बना होता है जिन्हें परमाणु (atoms) कहते हैं।
- एक ही तत्त्व के परमाणु सभी प्रकार से समान होते हैं अर्थात् उनका भार, आकृति आदि समान होते हैं।
- विभिन्न तत्त्वों के परमाणुओं के आकार, भार, रासायनिक गुण आदि भिन्न-भिन्न होते हैं।
- परमाणु न तो नष्ट किए जा सकते हैं और न ही उत्पन्न अर्थात् ये अविनाशी होते हैं।
- एक परमाणु वह सूक्ष्मतम कण है जो रासायनिक अभिक्रिया में भाग लेता है अर्थात् पूर्ण परमाणु न कि उनके भिन्न (fractions) रासायनिक अभिक्रिया में भाग लेते हैं।
- एक ही अथवा विभिन्न तत्त्वों के परमाणु संयुक्त होकर यौगिक परमाणु (compound atoms) बनाते हैं जिन्हें अब अणु (molecules) कहा जाता है।
- जब परमाणु संयुक्त होकर यौगिक परमाणु बनाते हैं तो उनकी संख्याओं में सरल पूर्ण संख्या अनुपात (1 : 1, 1 : 2, 2 : 1, 2: 3) होता है।
- दो तत्त्वों के परमाणु विभिन्न अनुपातों में संयोग करके एक से अधिक यौगिक बना सकते हैं।उदाहरणार्थ-सल्फर ऑक्सीजन से संयोग करके सल्फर डाइऑक्साइड (SO,) और सल्फर ट्राइऑक्साइड (SO) बनाता है जिनमें सल्फर और ऑक्सीजन का अनुपात क्रमशः 1:2 और 1: 3 होता है।
- परमाणु रासायनिक परिवर्तन में अपनी निजी सत्ता (individuality) बनाए रखते हैं।
डाल्टन के परमाणु सिद्धान्तं ने द्रव्य की आंतरिक रचना के बारे में काफी सटीक और सही जानकारी दी। साथ ही उससे रासायनिक संयोजन के नियमों की भी सही व्याख्या हुई परन्तु इस सिद्धान्त के कुछ दोष भी पाए गए जो निम्नवत् हैं-
- यह बता नहीं सका कि विभिन्न तत्त्वों के परमाणु किस प्रकार एक-दूसरे से भिन्न होते हैं अर्थात् उसने परमाणु की आंतरिक संरचना के बारे में कुछ नहीं बताया।
- यह गे-लुसैक के गैसीय आयतन के नियम की व्याख्या करने में असफल रहा।
- यह स्पष्ट नहीं कर सका कि परमाणु क्यों और कैसे जुड़कर यौगिक परमाणु बनाते हैं।
- यह अणु में परमाणुओं को बाँधे रखने वाले बल की प्रकृति के विषय में कुछ नहीं बता सका।
- यह अभिक्रिया में भाग लेने वाले तत्त्व के मूल कण (परमाणु) और स्वतन्त्र अवस्था में पाए जा सकने वाले मूल कण (अणु) में विभेद नहीं कर सका।
प्रश्न 3.
मोल संकल्पना का विस्तृत वर्णन कीजिए।
उत्तर :
परमाणुओं के निरपेक्ष द्रव्यमान ज्ञात करने के लिए यह अनिवार्य है कि हमें पदार्थ की निश्चित मात्रा में उपस्थित परमाणुओं अथवा अणुओं की संख्या ज्ञात हो। अध्ययन से यह पता चला है कि किसी भी तत्त्व के एक ग्राम परमाणु में समान संख्या में परमाणु होते हैं। इसी प्रकार किसी भी पदार्थ के एक ग्राम अणु में समान संख्या में अणु होते हैं। प्रयोगों द्वारा यह संख्या 6023×1023 ज्ञात हुई है। इस संख्या को ‘आवोगाद्रो संख्या’ या ‘आवोगाद्रो स्थिरांक’ कहते हैं तथा इसे NA द्वारा प्रदर्शित करते। हैं। किसी पदार्थ की वह मात्रा जिसमें 6023×1023 तात्विक कण पाये जाते हैं, एक मोल (mole) कहलाती है। दूसरे शब्दों में, एक मोल पदार्थ की वह मात्रा है जिसमें उतने ही तात्विक कण पाये जाते हैं जितने कि कार्बन-12 के 12 g(0.012 kg) में होते हैं। ‘मोल’ पद का प्रयोग परमाणु, अणु, आयन, इलेक्ट्रॉन आदि किसी के लिए भी किया जा सकता है। मोल परमाणुओं, अणुओं, आयनों आदि को गिनने का एक मात्रक है। जिस प्रकार एक दर्जन का तात्पर्य 12 वस्तुओं और एक स्कोर का तात्पर्य 20 वस्तुओं से है, ठीक उसी प्रकार मोल का तात्पर्य 6023×1023 कणों से है। इसका कणों की प्रकृति से कोई सम्बन्ध नहीं है।
किसी पदार्थ के एक मोल के ग्राम में व्यक्त द्रव्यमान को उसका मोलर द्रव्यमान (molar mass) कहते हैं। परमाणुओं की स्थिति में यह ग्राम परमाणु द्रव्यमान (gram atomic mass) और अणुओं की स्थिति में यह ग्राम आणविक द्रव्यमान (gram molecular mass) के समान होता है। इसे हम इस प्रकार भी कह सकते हैं कि किसी तत्त्व के 6023×1023 परमाणुओं का ग्राम में व्यक्त द्रव्यमान उसके ग्राम परमाणु द्रव्यमान अथवा एक ग्राम परमाणु के समान होता है। इसी प्रकार किसी तत्त्व अथवा यौगिक के 6023×1023 अणुओं का ग्राम में व्यक्त द्रव्यमान उसके ग्राम आणविक द्रव्यमान अथवा एक ग्राम अणु के समान होता है।
उदाहरणार्थ--6023×1023ऑक्सीजन परमाणुओं का द्रव्यमान = 16 g
-6023×1023 ऑक्सीजन अणुओं का द्रव्यमान = 32 g
6023×1023 जल अणुओं का द्रव्यमान = 18 g
यदि पदार्थ परमाणवीय (atomic) है तो मोलर द्रव्यमान 6023×1023 (आवोगाद्रो संख्या) परमाणुओं को द्रव्यमान होता है। ऐसे में हम मोलर द्रव्यमान को आवोगाद्रो संख्या से भाग देकर एक परमाणु का निरपेक्ष द्रव्यमान (absolute mass) ज्ञात कर सकते हैं। इसी प्रकार हम आणविक पदार्थों के एक अणु का निरपेक्ष द्रव्यमान भी ज्ञात कर सकते हैं।
एनसीईआरटी सोलूशन्स क्लास 11 रसायन विज्ञान पीडीएफ
- 2. परमाणु की संरचना
- 3. तत्वों का वर्गीकरण तथा गुणधर्मो में आवर्तिता
- 4. रासायनिक आबंधन तथा आण्विक संरचना
- 5. द्रव्य की अवस्थाएं
- 6. ऊष्मागतिकी
- 7. साम्यावस्था
- 8. अपचयोपचय अभिक्रियाएँ
- 9. हाइड्रोजन
- 10. S - ब्लॉक के तत्व
- 11. P - ब्लॉक के तत्व
- 12. कार्बनिक रसायन - कुछ आधारभूत सिद्धांत तथा तकनीकें
- 13. हाइड्रोकार्बन
- 14. पर्यावरणीय रसायन