NCERT Solutions Class 9 विज्ञान Chapter-3 (परमाणु एवं अणु)
Class 9 विज्ञान
पाठ-3 (परमाणु एवं अणु)
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
पाठ-3 (परमाणु एवं अणु)
पाठ्य – पुस्तक के प्रश्नोत्तर
पाठगत प्रश्न (पृष्ठ संख्या – 36)
प्रश्न 1.
एक अभिक्रिया में 5.3 g सोडियम कार्बोनेट एवं 6.0 g एथेनॉइक अम्ल अभिकृत होते हैं। 2.2 g कार्बन डाइऑक्साइड, 8.2 g सोडियम एथोनॉएट तथा 0.9 g जले उत्पाद के रूप में प्राप्त होते हैं। इस अभिक्रिया द्वारा दिखाइए कि यह परीक्षण द्रव्यमान संरक्षण के नियम के अनुरूप है।
सोडियम कार्बोनेट + एथेनॉइक अम्ल → सोडियम एथेनॉएट + कार्बन डाइऑक्साइड + जल
उत्तर-
दी गई रासायनिक अभिक्रिया निम्न प्रकार से है
सोडियम कार्बोनेट + एथेनॉइक अम्ल (जलीय विलयन) → सोडियम एथेनॉएट (जलीय विलयन) + कार्बन डाइऑक्साइड + जल
(i) अभिकर्मकों की कुल द्रव्यमान = सोडियम कार्बोनेट का द्रव्यमान + एथेनॉइक अम्ल का द्रव्यमान
= 5.3 g + 6.0 g = 11.3 g
(ii) उत्पादों का कुल द्रव्यमान = (सोडियम एथेनोएट + कार्बन डाइऑक्साइड + जल का द्रव्यमान)
= 8.2 g + 2.2 g + 0.9 g = 11.3 g
अभिकर्मकों का कुल द्रव्यमान तथा उत्पादों का कुल द्रव्यमान समान है।
अतः ये द्रव्यमान संरक्षण के नियम को प्रदर्शित करते हैं।
प्रश्न 2.
हाइड्रोजन एवं ऑक्सीजन द्रव्यमान के अनुसार 1 : 8 के अनुपात में संयोग करके जल बनाते हैं। 3g हाइड्रोजन गैस के साथ पूर्णतया संयोग करने के लिए कितने ऑक्सीजन गैस के द्रव्यमान की आवश्यकता होगी ?
उत्तर-
जल में संहति के अनुसार हाइड्रोजन तथा ऑक्सीजन का अनुपात = 1 : 8
1 ग्राम हाइड्रोजन पूर्णतया क्रिया करके जल बनाने के लिए आवश्यक ऑक्सीजन = 8 ग्राम
अत: 3 ग्राम हाइड्रोजन के पूर्णतया क्रिया करने के लिए आवश्यक ऑक्सीजन = 8 x 3 = 24 ग्राम।
प्रश्न 3.
डाल्टन के परमाणु सिद्धान्त का कौन-सा अभिग्रहीत द्रव्यमान के संरक्षण के नियम का परिणाम है?
उत्तर-
द्रव्यमान का की संरक्षण नियम डाल्टन के निम्नलिखित सिद्धान्त पर आधारित है – तत्त्व के परमाणुओं को किसी भी विधि द्वारा न तो नष्ट किया जा सकता है और न ही उत्पन्न किया जा सकता है।
प्रश्न 4.
डाल्टन के परमाणु सिद्धान्त का कौन-सा अभिग्रहीत निश्चित अनुपात के नियम की व्याख्या करता है?
उत्तर-
डाल्टन के परमाणु सिद्धान्त का निम्नलिखित अभिग्रहीत निश्चित अनुपात के नियम की व्याख्या करता है : किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं तथा भिन्न-भिन्न तत्त्वों के परमाणु परस्पर छोटी पूर्णसंख्या के अनुपात में संयोग कर यौगिक निर्मित करते हैं।
पाठगत प्रश्न (पृष्ठ संख्या – 40)
प्रश्न 1.
परमाणु द्रव्यमान इकाई को परिभाषित कीजिए।
उत्तर-
परमाणु द्रव्यमान इकाई : कार्बन-12 समस्थानिक के एक परमाणु के द्रव्यमान के वें भाग को परमाणु द्रव्यमान इकाई के रूप में लिया जाता है।
प्रश्न 2.
एक परमाणु को आँखों द्वारा देखना क्यों संभव नहीं होता है ?
उत्तर-
परमाणु बहुत सूक्ष्म होते हैं। ये किसी भी वस्तु जिसकी हम कल्पना या तुलना कर सकते हैं, से भी बहुत छोटे होते हैं। लाखों परमाणुओं को जब एक के ऊपर एक चट्टे के रूप में रखें, तो बड़ी कठिनाई से कागज की एक शीट जितनी मोटी परत बन पाएगी। परमाणु का आकार लगभग 10-10 m होता है
अतः हम इसे नगण्य मान सकते हैं जिसे आँखों द्वारा नहीं देख सकते।
पाठगत प्रश्न (पृष्ठ संख्या – 41)
प्रश्न 1.
सारणी में दिए गए यौगिकों की संख्या से तत्त्वों का अनुपात ज्ञात कीजिए।
पाठगत प्रश्न (पृष्ठ संख्या – 44)
प्रश्न 1.
निम्न के सूत्र लिखिए
(i) सोडियम ऑक्साइड
(ii) ऐलुमिनियम क्लोराइड
(iii) सोडियम सल्फाइड
(iv) मैग्नीशियम इड्रॉक्साइड
उत्तर-
(i) सोडियम ऑक्साइड का सूत्र
प्रश्न 2.
निम्नलिखित सूत्रों द्वारा प्रदर्शित यौगिकों के नाम लिखिए
(i) Al2(SO4)3
(ii) CaCl2
(iii) K2SO4
(iv) KNO3
(v) CaCO3
उत्तर-
(i) Al2(SO4)3 – ऐलुमिनियम सल्फेट
(ii) CaCl2 – कैल्सियम क्लोराइड
(iii) K2SO4 – पोटैसियम सल्फेट
(iv) KNO3 – पोटैसियम नाइट्रेट
(v) CaCO3 – कैल्सियम कार्बोनेट
प्रश्न 3.
रासायनिक सूत्र का क्या तात्पर्य है?
उत्तर-
किसी यौगिक का रासायनिक सूत्र उसके संघटक का प्रतीकात्मक निरूपण होता है।
प्रश्न 4.
निम्न में कितने परमाणु विद्यमान हैं?
(i) H2S अणु एवं
(ii) आयन?
उत्तर-
(i) H2S में तीन परमाणु हैं।
(ii) आयन में पाँच परमाणु हैं।
पाठगत प्रश्न (पृष्ठ संख्या – 46)
प्रश्न 1.
निम्न यौगिकों के आणविक द्रव्यमान को परिकलन कीजिए :
H2, O2, Cl2, CO2, CH4, C2H6, C2H4, NH3 एवं CH3OH
उत्तर-
(i) H2 का आणविक द्रव्यमान = 2 x 1 = 2u.
(ii) O2 को आणविक द्रव्यमाने = 2 x 16 = 32u.
(iii) Cl2 का आणविक द्रव्यमान 2 x 35.5 = 71u.
(iv) CO2 को आणविक द्रव्यमान = 12 + 2 x 16 = 12 + 32 = 44u.
(v) CH4 को आणविक द्रव्यमान = 12 + 4 x 1 = 12 + 4 = 16u.
(vi) C2H6 को द्रव्यमान = 2 x 12 + 6 x 1 = 24 + 6 = 30u.
(vii) C2H4 का आणविक द्रव्यमान = 2 x 12 + 4 x 1 = 24 + 4 = 28u.
(viii) NH3 को आणविक द्रव्यमान = 14 + 3 x 1 = 14 + 3 = 17u.
(ix) CH3OH का आणविक द्रव्यमान = 12 + 3 x 1 + 16 + 1 = 12 + 3 + 16 + 1 = 32u.
प्रश्न 2.
निम्नलिखित यौगिकों के सूत्र इकाई द्रव्यमान का परिकलन कीजिए-
ZnO, Na2O, K2CO3.
दिया गया है।
Zn का परमाणु द्रव्यमान = 65u
Na का परमाणु द्रव्यमान = 23u
K का परमाणु द्रव्यमान = 39u
C का परमाणु द्रव्यमान = 12u
O का परमाणु द्रव्यमान = 16u
उत्तर-
(i) ZnO का सूत्र इकाई द्रव्यमान = 65 + 16 = 81u.
(ii) Na2O का सूत्र इकाई द्रव्यमान = 2 x 23 + 16 = 46 + 16 = 62 u.
(iii) K2SO3 का सूत्र इकाई द्रव्यमान = 2 x 39 + 12 + 3 x 16 = 78 + 12 + 48 = 138 u.
पाठगत प्रश्न (पृष्ठ संख्या – 48)
प्रश्न 1.
यदि कार्बन परमाणुओं के एक मोल का द्रव्यमान 12 g है तो कार्बन के एक परमाणु का द्रव्यमान क्या होगा ?
प्रश्न 2.
किसमें अधिक परमाणु होंगे : 100 g सोडियम अथवा 100 g लोहा (Fe) ? (Na का परमाणु द्रव्यमान = 23 u, Fe का परमाणु द्रव्यमान = 56 u)
उत्तर-
1 मोल सोडियम का द्रव्यमान = 23 g
100 g सोडियम में मोलों की संख्या = = 4.35 मोल।
1 मोल लोहे की द्रव्यमान = 56 g
100 g लोहे में मोलों की संख्या = = 1.8 मोल
क्योंकि 100 g सोडियम में मोलों की संख्या 100 g लोहे में मोलों की संख्या से अधिक है
अतः 100 g सोडियम में अधिक परमाणु होंगे।
अभ्यास प्रश्न (पृष्ठ संख्या 50 – 51)
प्रश्न 1.
0.24 g ऑक्सीजन एवं बोरॉन युक्त यौगिक के नमूने में विश्लेषण द्वारा यह पाया गया कि उसमें 0.096 g बोरॉन एवं 0.144 g ऑक्सीजन है। उस यौगिक के प्रतिशत संघटन का भारात्मक रूप में परिकलन कीजिए।
उत्तर-
यौगिक का कुल द्रव्यमान = 0.24 g
प्रश्न 2.
3.0g कार्बन 8.00g ऑक्सीजन में जलकर 11.00g कार्बन डाइऑक्साइड निर्मित करता है। जब 3.00g कार्बन को 50.0g ऑक्सीजन में जलाया जाता है तो कितने ग्राम कार्बन डाइऑक्साइड का निर्माण होगा। आपका उत्तर रासायनिक संयोजन के किस नियम पर आधरित होगा ?
उत्तर-
क्योंकि 3.0g कार्बन 8.0g ऑक्सीजन में जलाया जाता है तो 11.0g कार्बन डाइऑक्साइड प्राप्त होती है इसलिए 3.0g कार्बन को जब 50.0g ऑक्सीजन में जलाया जाएगा तो वह केवल 8.0g ऑक्सीजन के साथ संयोग करके 11.0g कार्बन डाइऑक्साइड बनाएगा। शेष (50 – 8 = 42g) ऑक्सीजन बिना अभिक्रिया करे बची रहेगी। यह संहति के स्थिर अनुपात के नियम के अनुरूप है।
प्रश्न 3.
बहुपरमाणुक आयन क्या होते हैं? उदाहरण दीजिए।
उत्तर-
बहुपरमाणुक आयन-जब एक से अधिक तत्त्वों के परमाणु आपस में जुड़कर एक सामान्य धनावेशित या ऋणावेशित आयन बनाते हैं तो उन्हें बहुपरमाणुक आयन कहते हैं। सामान्यतः बहुपरमाण्विक आयन ऋणआवेशित। अधिक संख्या में पाए जाते हैं।
प्रश्न 4.
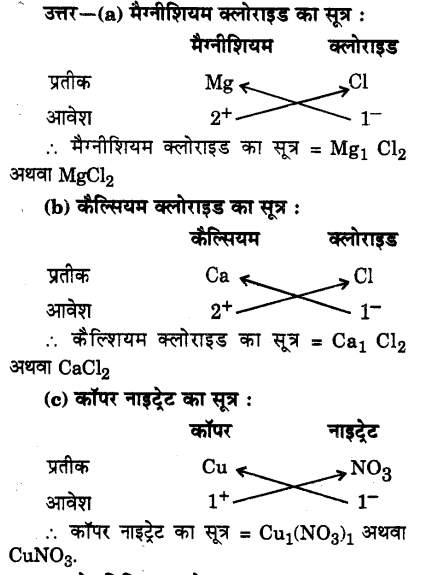
निम्नलिखित के रासायनिक सूत्र लिखिए :
(a) मैग्नीशियम क्लोराइड
(b) कैल्शियम क्लोराइड
(c) कॉपर नाइट्रेट
(d) ऐलुमिनियम क्लोराइड
(e) कैल्शियम कार्बोनेट।
प्रश्न 5.
निम्नलिखित यौगिकों में विद्यमान तत्त्वों का नाम दीजिए ।
(a) बुझा हुआ चूना
(b) हाइड्रोजन ब्रोमाइड
(c) बेकिंग पाउडर (खाने वाला सोडा)
(d) पोटैशियम सल्फेट
प्रश्न 6.
निम्नलिखित पदार्थों के मोलर द्रव्यमान का परिकलन कीजिए :
(a) एथाइन (C2H2)
(b) सल्फर अणु (S8)
(c) फॉस्फोरस अणु (P4) (फॉस्फोरस का परमाणु द्रव्यमान = 31)
(d) हाइड्रोक्लोरिक अम्ल (HCl)
(e) नाइट्रिक अम्ल (HNO3).
उत्तर-
(a) एथाइन (C2H2) का मोलर द्रव्यमान = (12 x 2) + (1 x 2) = 24 + 2 = 26 g
(b) सल्फर (S8) अणु का मोलर द्रव्यमान = 32 x 8 = 256 g
(c) फॉस्फोरस अणु (P4) का मोलर द्रव्यमान = 31 x 4 = 124 g
(d) हाइड्रोक्लोरिक अम्ल (HCl) का मोलर द्रव्यमान = 1 + 35.5 = 36.5 g
(e) नाइट्रिक अम्ल (HNO3) का भोलर द्रव्यमान = 1 + 14 + (3 x 16) = 1 + 14 + 48 = 63 g.
प्रश्न 7.
निम्नलिखित का द्रव्यमान क्या होगा :
(a) एक मोल नाइट्रोजन परमाणु?
(b) 4 मोल ऐलुमिनियम परमाणु (ऐलुमिनियम का परमाणु द्रव्यमान = 27)?
(c) 10 मोल सोडियम सल्फाइट (Na2SO3)?
उत्तर-
(a) एक मोल नाइट्रोजन परमाणु = नाइट्रोजन परमाणु का मोलर द्रव्यमान = 14g
(b) एक मोल ऐलुमिनियम परमाणु = ऐलुमिनियम परमाणु का मोलर द्रव्यमान = 27g
4 मोल ऐलुमिनियम परमाणु का मोलर द्रव्यमान = 27 x 4 = 108g
(c) एक मोल Na2SO3 का द्रव्यमान = (23 x 2) + (1 x 32) + (16 x 3) = 46 + 32 + 48 = 126g
प्रश्न 8.
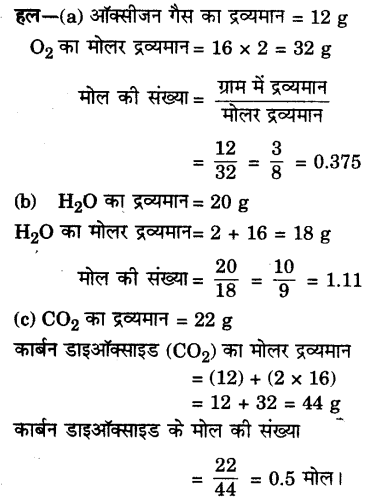
निम्न को मोल में परिवर्तित करो
(a) 12 g ऑक्सीजन गैस
(b) 20 g पानी
(c) 22 g कार्बन डाइऑक्साइडे।
प्रश्न 9.
निम्न को द्रव्यमान क्या होगा :
(a) 0.2 मोल ऑक्सीजन परमाणु ?
(b) 0.5 मोल जल के अणु ?
उत्तर-
(a) ऑक्सीजन के परमाणु मोल की संख्या = 0.2
ऑक्सीजन के परमाणु का मोलर द्रव्यमान = 16 g
ऑक्सीजन के परमाणु के 0.2 मोल का द्रव्यमान = 16 x 0.2 = 3.2 g
(b) जले के मोलों की संख्या = 0.5
जल का मोलर द्रव्यमान = 2 + 16 = 18 g
0.5.मोल पानी का द्रव्यमान = 18 x 0.5 = 9.0 g.
प्रश्न 10.
16 g ठोस सल्फर में सल्फर (S8) के अणुओं की संख्या की परिकलन कीजिए।
प्रश्न 11.
0.051 g ऐलुमिनियम ऑक्साइड (Al2O3) में ऐलुमिनियम ऑयन की संख्या का परिकलने कीजिए।
अन्य महत्वपूर्ण प्रश्नोत्तर
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
आवोगाद्रो स्थिरांक से क्या समझते हो ?
उत्तर-
एक मोल कणों की संख्या 6.022 x 1023 को आवोगाद्रो स्थिरांक कहते हैं।
प्रश्न 2.
रासायनिक संयोजन के नियमों को सर्वप्रथम किसने प्रतिपादित किया ?
उत्तर-
एन्टोनी एल. लेवॉशिये एवं जोसेफ एल. प्राउस्ट ने प्रतिपादित किया था।
प्रश्न 3.
2H तथा H2 में क्या अन्तर है ?
उत्तर-
2H, हाइड्रोजन के 2 परमाणु प्रदर्शित करती है तथा H2 हाइड्रोजन का एक अणु प्रदर्शित करती है।
प्रश्न 4.
एक amu या ‘u’ क्या है ?
उत्तर-
कार्बन (C-12) का वाँ द्रव्यमान amu या (unified mass) कहलाता है।
प्रश्न 5.
किस भारतीय दार्शनिक ने पदार्थ के अविभाज्य कण को ‘परमाणु’ कहा?
उत्तर-
महर्षि कणाद ने।
प्रश्न 6.
द्रव्यमान संरक्षण का नियम क्या है ?
उत्तर-
किसी भी अभिक्रिया में, अभिकारकों और उत्पादों के द्रव्यमानों का योग अपरिवर्तनीय रहता है।
यह द्रव्यमान संरक्षण का नियम है।
प्रश्न 7.
किसी पदार्थ का आणविक द्रव्यमान क्या
उत्तर-
किसी पदार्थ का आणविक द्रव्यमान उसके सभी संघटक परमाणुओं के द्रव्यमान का योग होता है।
प्रश्न 8.
‘सूत्र इकाई द्रव्यमान’ क्या है ?
उत्तर-
किसी पदार्थ का सूत्र इकाई द्रव्यमान’ उसके सभी संघटक परमाणुओं के परमाणु द्रव्यमानों का योग होता है।
प्रश्न 9.
एक आयन क्या है ?
उत्तर-
एक परमाणु या परमाणुओं का समूह, जो आवेशित हो, आयन कहलाता है।
प्रश्न 10.
Na तथा Na+ में क्या अन्तर है ?
उत्तर-
Na सोडियम का परमाणु तथा Na+ सोडियम का आयन है।
प्रश्न 11.
He तथा P4 की परमाणुकता क्या है ?
उत्तर-
He की परमाणुकता 1 तथा P4 की परमाणुकता 4 है।
प्रश्न 12.
1 नैनोमीटर को मीटर में व्यक्त कीजिए।
उत्तर-
1 नैनोमीटर = 10-9 मीटर
प्रश्न 13.
अमोनियम क्लोराइड का सूत्र लिखिए।
उत्तर-
अमोनियम क्लोराइड का सूत्र NH4Cl है।
प्रश्न 14.
मोलर द्रव्यमान से क्या समझते हो?
उत्तर-
किसी पदार्थ के एक मोल के ग्राम में व्यक्त द्रव्यमान को मोलर द्रव्यमान कहते हैं।
प्रश्न 15.
संयोजकता से क्या समझते हो?
उत्तर-
किसी परमाणु या मूलक की संयोजन क्षमता को संयोजकता कहते हैं।
प्रश्न 16.
प्रत्येक का एक उदाहरण दीजिए
(i) त्रिपरमाणुक अणु
(ii) बहुपरमाणुक अणु
उत्तर-
(i) O3
(ii) S8
प्रश्न 17.
हाइड्रोजन गैस के 1 मोल में कितने H2O अणु होते हैं ?
उत्तर-
हाइड्रोजन गैस के 1 मोल में 6.022 x 1023 H2O अणु होते हैं।
प्रश्न 18.
निम्नलिखित यौगिकों के रासायनिक सूत्र लिखिए
(i) सल्फ्यूरिक अम्ल
(ii) कैल्शियम हाइड्रॉक्साइड।
उत्तर-
(i) H2SO4
(ii) Ca(OH)2
प्रश्न 19.
ऑक्सीजन का परमाणु द्रव्यमान 16u है, O2 का मोलर द्रव्यमान क्या है?
उत्तर-
O2 का आणविक द्रव्यमान = 16 x 2 = 32u
अतः O2 का मोलर द्रव्यमान = 32 g.
प्रश्न 20.
A2+ तथा Y– के संयोग से बने यौगिक का सूत्र लिखिए।
उत्तर-
AY2.
प्रश्न 21.
निम्नलिखित द्वारा उत्पन्न यौगिकों का सूत्र और नाम लिखिए
(i) Fe3+ और
(ii) NH4+ और
उत्तर-
(i) Fe2(SO4)3 आयन (III) सल्फेट
(ii) (NH4)2 CO3 अमोनियम कार्बोनेट।
लघु उत्तरीय प्रश्न
प्रश्न 1.
(a) परिभाषित कीजिए :
(i) एक मोल
(ii) आवोगाद्रो स्थिरांक
(b) S8 अणु का मोलर द्रव्यमान ज्ञात कीजिए। (परमाणु द्रव्यमान S = 32 u)
उत्तर-
(a) (i) एक मोल : किसी पदार्थ का एक मोल उसकी वह मात्रा है जिसमें उतने ही कण उपस्थित होते हैं, जितने कार्बन -12 समस्थानिक के ठीक 12 ग्राम (या 0.012 kg) में परमाणुओं की संख्या होती है।
(ii) आवोगादो स्थिरांक : कार्बन-12 के ठीक 12 g में परमाणुओं की संख्या 6.023 x 1023 है।
यह 6.023 x 1023 संख्या आवोगाद्रो स्थिरांक कहलाती है।
(b) सल्फर (S8) अणु का मोलर द्रव्यमान = 8 x 32 = 256 u
प्रश्न 2.
(a) परमाणुकता की परिभाषा लिखिए।
(b) निम्नलिखित अणुओं की परमाणुकता लिखिएः
(i) ऑक्सीजन
(ii) फास्फोरस
(iii) सल्फर
(iv) आर्गन।
उत्तर-
(a) परमाणुकता : किसी पदार्थ के सरल अणु में प्रयुक्त होने वाले परमाणुओं की संख्या, अणु की परमाणुकता कहलाती है।
प्रश्न 3.
डॉल्टन के परमाणु सिद्धान्त की उन दो अवधारणाओं को लिखिए जो कि :
(i) द्रव्यमान संरक्षण के नियम, तथा
(ii) स्थिर अनुपात के नियम की व्याख्या करती हों।
उत्तर-
(i) परमाणु अविभाज्य सूक्ष्मतम कण होते हैं। जो रासायनिक अभिक्रिया में न तो सृजित होते हैं, न ही उनका विनाश होता है।
(ii) किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं।
प्रश्न 4.
द्रव्यमान संरक्षण के नियम का वर्णन कीजिए। यदि कार्बन के 12 g का ऑक्सीजन में 32 g की उपस्थिति में दहन किया जाए, कितनी कार्बन डाइऑक्साइड का निर्माण होगा ?
उत्तर-
द्रव्यमान संरक्षण को नियम : रासायनिक अभिक्रिया में, उत्पादों का कुल द्रव्यमान, अभिकारकों के कुले द्रव्यमान के बराबर होता है। रासायनिक अभिक्रिया के दौरान द्रव्यमान में कोई परिवर्तन नहीं होता है।
अभिकारकों का द्रव्यमान = (12 + 32) g = 44 g
उत्पादों (CO2) का द्रव्यमान = 44 g
प्रश्न 5.
आवोगाद्रो स्थिरांक को परिभाषित कीजिए। यह मोल से कैसे सम्बन्धित है ?
उत्तर-
आवोगाद्रो स्थिरांक, किसी भी पदार्थ के एक ग्राम अणु में अणुओं की वास्तविक संख्या को कहते हैं। इसका मान 6.022 x 1023 कण हैं।
1 मोल = 6.022 x 1023 संख्या
प्रश्न 6.
(a) बहुपरमाणुक आयन क्या हैं ?
(b) (i) Fe3+ तथा
(ii) NH4+ तथा के संयोग से बने यौगिकों के नाम तथा सूत्र लिखिए।
उत्तर-
(a) परमाणुओं का समूह जिस पर आवेश होता है, बहुपरमाणु आयन कहलाते हैं।
उदाहरण : कार्बनिक आयन,
(b) (i) Fe2(SO4)3 आयरन सल्फेट,
(ii) (NH4)2 CO3 अमोनियम कार्बोनेट।
प्रश्न 7.
(a) उस संस्था का नाम बताइए जो तत्त्वों के नामों को स्वीकृति प्रदान करती है।
(b) सोडियम का प्रतीक Na लिखा जाता है और S नहीं। कारण दीजिए।
(c) एक तत्त्व का नाम बताइए जो द्विपरमाणुक अणु तथा एक तत्त्व जो चतुर्परमाणुक अणु बनाता है।
उत्तर-
(a) आजकल इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड कैमिस्ट्री (IUPAC) तत्त्वों के नामों को स्वीकृति प्रदान करती है।
(b) सोडियम का प्रतीक लैटिन नाम नैट्रियम से व्युत्पन्न किया गया है। इसलिए सोडियम को Na लिखा गया है।
(c) (i) तत्त्व जो द्वि-परमाणुक अणु बनाता हैहाइड्रोजन (H2)।
(ii) तत्त्व जो चतुर्परमाणुक अणु बनाता है- फास्फोरस (P4)।
प्रश्न 8.
एक किग्रा जल में मोल की संख्या क्या होगी ?
प्रश्न 9.
परमाणु क्या है ? परमाणु आकार में कितने बड़े हैं ? उसका महत्व बताइए।
उत्तर-
परमाणु किसी तत्त्व का सूक्ष्मतम कण है, जिसका अपना अस्तित्त्व है और यह तत्त्वे के सभी गुणधर्म प्रदर्शित करता है। यह द्रव्य की रचनात्मक इकाई है।
परमाणु बहुत सूक्ष्म होता है। हाइड्रोजन के एक परमाणु की त्रिज्या 10-10 m या 0.1 nm है- ‘nm’ को हम नैनोमीटर बोलते हैं।
1 nm = 10-9 मीटर
परमाणु का महत्त्व : निश्चय ही परमाणु अत्यंत सूक्ष्म हैं, फिर भी महत्त्वहीन नहीं हैं। वे द्रव्य की रचनात्मक इकाई हैं और विभिन्न द्रव्य अलग-अलग तरह के परमाणुओं से निर्मित होते हैं।
प्रश्न 10.
किसी यौगिक का प्रतिशत संघटन क्या है ? किसी तत्व की यौगिक में प्रतिशत मात्रा कैसे ज्ञात करते हैं ?
उत्तर-
किसी यौगिक में उपस्थित तत्त्वों की मात्रा प्रति 100 भाग में प्रदर्शित करना, यौगिक का प्रतिशत संघटन कहलाता है। किसी यौगिक में उपस्थित तत्त्वों की प्रतिशत मात्रा निम्न प्रकार ज्ञात करते हैं.
1. यौगिक का अणु द्रव्यमान ज्ञात कीजिए।
2. यौगिक के संघटन में उपस्थित विभिन्न तत्त्वों की प्रतिशत मात्रा निम्न प्रकार ज्ञात कीजिए-
प्रश्न 11.
ग्लूकोज (C6H12O6) का प्रतिशत संघटन ज्ञात कीजिए।
प्रश्न 12.
सोडियम-हाइड्रॉक्साइड (NaOH) का प्रतिशत संघटन लिखिए।
प्रश्न 13.
अमोनियम नाइट्रेट (NH4NO3) व यूरिया (NH2CONH2) दो सामान्य उर्वरक हैं। ज्ञात कीजिए कि कौन-सा उर्वरक नाइट्रोजन की अधिक प्रतिशत मात्रा देता है।
(N = 14u, H = 1u, O = 16u, C = 12u)
प्रश्न 14.
डाल्टन का परमाणु सिद्धान्त लिखिए।
उत्तर-
जॉन डाल्टन (John Dalton) ने अनेक यौगिकों के संघटन का अध्ययन किया और 1803 में निम्न | सिद्धान्त का प्रतिपादन किया जो डाल्टन के परमाणु सिद्धांत के नाम से जाना जाता है
(i) सभी द्रव्य अतिसूक्ष्म कणों से मिलकर बने हैं, जिन्हें परमाणु (Atom) कहते हैं। परमाणु अविभाज्य है, अर्थात् इसे अन्य छेटे कणों में विभाजित नहीं किया जा सकता।
(ii) किसी तत्त्व विशेष के सभी परमाणु, भार (द्रव्यमान) व रासायनिक गुणधर्म में समान होते हैं, लेकिन विभिन्न तत्त्वों के परमाणु, भारे (द्रव्यमान) व रासायनिक गुणधर्म में अलग-अलग होते हैं।
(iii) तत्त्वों के परमाणुओं के विभिन्न प्रकार से संयोग करने से विभिन्न प्रकार के सरल व जटिल पदार्थ बनते हैं।
(iv) किसी रासायनिक अभिक्रिया के फलस्वरूप न तो परमाणुओं का सृजन किया जा सकता है न विनाश।
(v) किसी यौगिक में संयोग करने वाले परमाणुओं की संख्या निश्चित रहती है।
प्रश्न 15.
कार्बन डाइऑक्साइड का सूत्र प्राप्त कीजिए।
उत्तर-
हम कार्बन डाइऑक्साइड के सूत्र को निम्न प्रकार प्राप्त कर सकते हैं :
1. कार्बन डाइऑक्साइड, कार्बन और ऑक्सीजन से बना एक यौगिक है। इसलिए, पहले हम कार्बन (C) और ऑक्सीजन (O) के प्रतीकों को लिखते हैं।
2. कार्बन की संयोजकता 4 है और ऑक्सीजन की संयोजकता 2 है। इसलिए, प्रतीक C के नीचे हम 4 लिखते हैं और प्रतीक O के नीचे हम 2 लिखते हैं-
3. C और O परमाणुओं की संयोजकताओं का विनिमय करते हैं। सूत्र C2O4 हो जाता है। इस सूत्र में 2 के सामान्य गुणक वाले 2 कार्बन परमाणु गुणक से भाग देने पर, हम सरलतम सूत्र CO2 पाते हैं। अतः कार्बन डाइऑक्साइड का सूत्र CO2 है।
प्रश्न 16.
हाइड्रोजन क्लोराइड का सूत्र प्राप्त कीजिए।
उत्तर-
हाइड्रोजन क्लोराइड, हाइड्रोजन और क्लोरीन तत्त्व का बना है। हाइड्रोजन का प्रतीक H है और क्लोरीन का प्रतीक Cl है। हाइड्रोजन की संयोजकता 1 है और क्लोरीन की संयोजकता भी 1 है। हाइड्रोजन क्लोराइड के सूत्र को निम्न प्रकार प्राप्त किया जा सकता है-
प्रश्न 17.
कार्बन की संयोजकतो 4 है और क्लोरीन की संयोजकता 1 है। कार्बन टेट्राक्लोराइड का सूत्र क्या होगा?
प्रश्न 18.
निम्न के अणु द्रव्यमान एवं एक मोल की गणना कीजिए-
(i) NaOH
(ii) CaCO3
(iii) (NH4)2SO4
उत्तर-
(i) NaOH का अणु द्रव्यमान। = Na का परमाणु द्रव्यमान x 1 + O का परमाणु द्रव्यमान x 1 + H का परमाणु द्रव्यमान x 1
= 23 x 1 + 16 x 1 + 1 x 1 = 23 + 16 + 1 = 40 u
NaOH का एक मोल = 40 ग्राम
(ii) CaCO3 का अणु द्रव्यमान = Ca का परमाणु द्रव्यमान x 1 + C का परमाणु द्रव्यमान x 1 + O का परमाणु द्रव्यमान x 3
= 40 x 1 + 12 x 1 + 16 x 3 = 40 + 12 + 48 u = 100
CaCO3 का एक मोल = 100 ग्राम
(iii) (NH4)2 SO4 का अणु द्रव्यमान = (N का परमाणु द्रव्यमान x 1 + H का परमाणु द्रव्यमान x 4) x 2 + S का परमाणु द्रव्यमान x 1 + O का परमाणु द्रव्यमान x 4
= (14 x 1 + 1 x 4) x 2 + 32 x 1 + 16 x 4
= (14 + 4) x 2 + 32 + 64
= 18 x 2 + 32 + 64
= 36 + 32 + 64
= 132 u
(NH4)2SO4 को एक मोल = 132 ग्राम
दीर्घ उत्तरीय प्रश्न|
प्रश्न 1.
मोल संकल्पना क्या है? इसकी आवश्यकता पर प्रभाव डालते हुए मोलर द्रव्यमान को परिभाषित कीजिए।
उत्तर-
किसी पदार्थ का एक मोल उसकी वह मात्रा। है जिसमें उतने ही कण उपस्थित होते हैं, जितने कार्बन-12 समस्थानिक के ठीक 12 g (या 0.012 kg) में परमाणु की संख्या होती है।
किसी पदार्थ के एक मोल में कणों की संख्या सदैव समान होगी भले ही वह कोई भी पदार्थ हो। इस संख्या के सही निर्धारण के लिए कार्बन-12 परमाणु का द्रव्यमान, द्रव्यमान स्पेक्ट्रममापी द्वारा ज्ञात किया गया जिसका मान 1.992648 x 10-23 g प्राप्त हुआ। कार्बन के 1 मोल का द्रव्यमान 12 g होता है, अत: कार्बन के 1 मोल में परमाणुओं की संख्या निम्न प्रकार होगी :
इसे आवोगाद्रो संख्या कहते हैं तथा N या NA से व्यक्त करते हैं।
मोलर संकल्पना की आवश्यकता : मोल संकल्पना के अनुसार 12 ग्राम कार्बन में 6.022 x 1023 (आवोगाद्रो संख्या) कार्बन-परमाणु होते हैं। चूँकि इन कणों को गिनना सम्भव नहीं है, अतः इनकी संख्या को मोल में व्यक्त करके कार्य करना सरल हो जाता है।
उदाहरण-1 मोल में ऑक्सीजन परमाणुओं की संख्या = 6.022 x 1023
इसलिए 3 मोल में ऑक्सीजन परमाणुओं की संख्या = 3 x 6.022 x 1023 = 1.81 x 1024 परमाणु
उदाहरण से स्पष्ट है कि ऑक्सीजन परमाणुओं की संख्या 1.81 x 1024 में व्यक्त करना अपेक्षाकृत कठिन कार्य है, जबकि इन्हें 3 मोल ऑक्सीजन परमाणु के रूप में व्यक्त करना अत्यन्त सरल है। इसके अनुसार-
मोलर द्रव्यमान – किसी पदार्थ के एक मोल के ग्राम में व्यक्त द्रव्यमान को उसका ‘मोलर द्रव्यमान’ कहते हैं।
उदाहरणार्थ, सोडियम क्लोराइड का मोलर द्रव्यमान = 58.5 g
प्रश्न 2.
स्थिर अनुपात का नियम क्या है ? उदाहरण सहित समझायें।
उत्तर-
स्थिर अनुपात का नियम (Law of Constant Proportion) : प्राउस्ट (Proust 1779 के अनुसार, “किसी यौगिक में दो या अधिक तत्त्व एक निश्चित अनुपात में संयोजन करते हैं।”
अथवा
“किसी रासायनिक यौगिक में तत्त्व हमेशा द्रव्यमानों के निश्चित अनुपात में विद्यमान होते हैं।”
उदाहरण के लिए अगर हम जल किसी भी स्रोत नदी, तालाब, झरना आदि से लें। शुद्ध जल में 1 ग्राम हाइड्रोजन सदैव 8 ग्राम ऑक्सीजन से संयोग करती है या हम कह सकते हैं कि हाइड्रोजन व ऑक्सीजन के द्रव्यमानों में 1 : 8 अनुपात होता है।
इसी प्रकार, कार्बन डाइऑक्साइड हम किसी भी तरह उत्पादित करें जैसे :
(i) किसी ईंधन या कोयले के दहन से
(ii) चूना पत्थर को गर्म करके
(iii) संगमरमर पर तनु अम्ल की अभिक्रिया से
(iv) श्वसन द्वारा।
कार्बन डाइऑक्साइड में कार्बन और ऑक्सीजन के द्रव्यमानों में 3 : 8 का अनुपात होगा।
प्रश्न 3.
एक प्रयोग में 1.5 g हाइड्रोजन जलने पर 13.5 g जल उत्पन्न करती है और दूसरे प्रयोग में 3.6 g जल का विद्युत अपघटन करने पर 0.4g हाइड्रोजन व 3.2 g ऑक्सीजन प्राप्त होती है। दिखाइए कि उपर्युक्त आँकड़े स्थिर अनुपात के नियम का अनुमोदन करते हैं।
उत्तर-
I. हाइड्रोजन का द्रव्यमान = 1.5 g
जल का द्रव्यमान = 13.5 g
ऑक्सीजन का द्रव्यमान = 13.5 – 1.5 = 12.0 g
अतः 1.5 g हाइड्रोजन अभिक्रिया करती है 12.0 g ऑक्सीजन से
1.0 g हाइड्रोजन अभिक्रिया करती है। = = 8.0 g ऑक्सीजन से
II. हाइड्रोजन का द्रव्यमान = 0.4 g
ऑक्सीजन का द्रव्यमान = 3.2 g
अत: 0.4 g हाइड्रोजन अभिक्रिया करती है 3.2 g ऑक्सीजन से
1.0 g हाइड्रोजन अभिक्रिया करती है = = 8.0 g ऑक्सीजन से
अतः दोनों ही प्रेक्षणों में 1 g हाइड्रोजन 8 g ऑक्सीजन से संयोग करती है। उपर्युक्त आँकड़े स्थिर अनुपात के नियम का अनुमोदन करते हैं।
प्रश्न 4.
कुछ सामान्य तत्त्वों के नाम दीजिए और उनके प्रतीक लिखिए।
उत्तर-
जैसे-जैसे वैज्ञानिक अन्य तत्त्वों से परिचित होते गए, तत्त्वों की संख्या में वृद्धि होती गयी और उन्हें सामान्य प्रतीकों से प्रदर्शित करना मुश्किल होता गया।
डाल्टन (Dalton) पहले वैज्ञानिक थे जिन्होंने तत्त्वों के प्रतीकों का प्रयोग अत्यंत विशिष्ट अर्थ में किया। डाल्टन द्वारा प्रयोग किए प्रतीक (symbols) निम्न प्रकार थे :
चित्र : डाल्टन द्वारा सुझाये गए कुछ तत्त्वों के प्रतीक
इसके पश्चात् स्वीडन के वैज्ञानिक जे. जे. वर्जीलियस ने यह सुझाव दिया कि तत्त्व के नाम का प्रथम अक्षर उसको प्रदर्शित करने के लिए प्रतीक के रूप में प्रयोग किया जाए। उदाहरण के लिए, हाइड्रोजन (Hydrogen) के लिए H, कार्बन (Carbon) के लिए C, नाइट्रोजन (Nitrogen) के लिए N, आदि का प्रयोग तत्त्व के संकेत के रूप में किया गया। यह पद्धति कुछ संशोधनों के साथ आज भी प्रचलित है।
इस पद्धति में, कुछ समस्याएँ आयीं जैसे कई ऐसे तत्त्व हैं जिनका नाम एक ही अक्षर से आरम्भ होता है, जैसे :
कार्बन Carbon
क्रोमियम Chromium
कैल्सियम Calcium
कोबाल्ट Cobalt
क्लोरीन Chlorine
कॉपर Copper
जब दो या अधिक तत्त्वों का नाम एक ही अक्षर से आरम्भ हो तब केवल एक ही तत्त्व एक अक्षर द्वारा प्रदर्शित किया जाता है, अन्य तत्त्व को प्रदर्शित करने के लिए दो अक्षरों का प्रयोग करते हैं, इनमें पहला अक्षर अँग्रेजी का बड़ा अक्षर (Block letter of English alphabet) व दूसरा अक्षर छेटा प्रयोग करते हैं। इस प्रकार उपर्युक्त स्थिति में प्रतीक निम्न प्रकार होंगे।
कार्बन Carbon C
क्रोमियम Chromium Cr
कैल्सियम Calcium Ca
कोबाल्ट Cobalt Co
क्लोरीन Chlorine Cl
कॉपर Copper Cu
तत्त्वों के प्रतीक लिखने में सामान्य नियम
1. तत्त्व का प्रतीक सदैव अंग्रेजी वर्णमाला के बड़े अक्षर द्वारा प्रदर्शित किया जाता है।
2. यदि तत्त्व का प्रतीक दो अक्षरों द्वारा प्रदर्शित हो तो पहला अक्षर बड़ा व दूसरा अक्षर छोटा होगा।
3. कुछ तत्त्वों के प्रतीक सीधे इनके अंग्रेजी नामों से लिए गए हैं। अन्य कुछ तत्त्वों के प्रतीक इनके लैटिन नामों से लिए गये हैं जो नाम से एकदम भिन्न दिखाई देते हैं जैसे-सोडियम का प्रतीक है Na व पोटैशियम का प्रतीक K जो उनके लैटिन नामों नेट्रियम (Natrium) व केलियम (Kalium) से लिए गये
प्रश्न 5.
निम्न को मोल में प्रदर्शित कीजिए
(i) 14.7 ग्राम H2SO4
(ii) 2.2 ग्राम CO2
(iii) 3.15 ग्राम HNO3
(iv) 64.4 ग्राम NaOH
(H = 1u, S = 32u, O = 16u, C = 12u, N = 14u, Na = 23u)
प्रश्न 6.
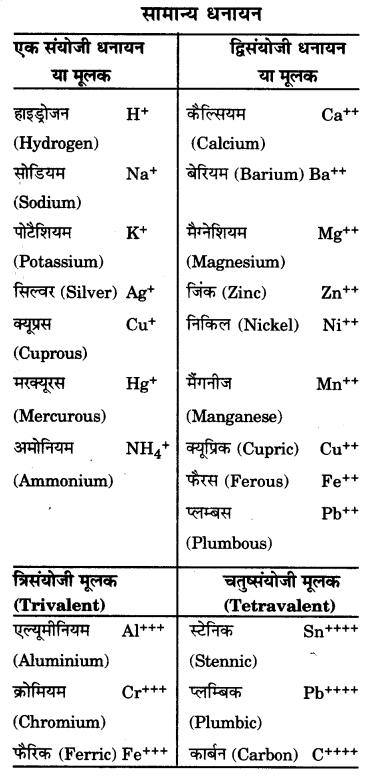
आयन क्या हैं? ये कितने प्रकार के हैं? कुछ सामान्य बहुपरमाणुक आयन लिखिए।
उत्तर-
आयन (Ion) : आवेशित परमाणु या परमाणुओं का समूह आयन कहलाता है। आवेशित परमाणुओं के समूह मूलक (radicals) भी कहे जाते हैं। आवेश के आधार पर आयन दो प्रकार के हैं :
(i) धनायन (Positive ion or cation)
(ii) ऋणायन (Negative ion or anion)
(i) धनायन : धन आवेशित आयन धनायन (Cation) कहलाते हैं।
(ii) ऋणायन : ऋण आवेशित आयन ऋणायन (Anion) कहलाते हैं।
आयन पर उपस्थित आवेश संयोजकता (Valency) कहलाता है।
बहुपरमाणुक आयन : दो या अधिक परमाणुओं का समूह जिस पर नेट आवेश विद्यमान रहता है, बहुपरमाणुक आयन कहलाता है।
उदाहरण-
(i) बहुपरमाणुक धनायन – NH4+ (अमोनियम आयन)।
(ii) बहुपरमाणुक ऋणायन OH– (हाइड्रॉक्साइड आयन), (कार्बोनेट आयन)
(सल्फेट आयन),
(फॉस्फेट आयन)।
[नोट : जब कोई आयन दो या दो से अधिक संयोजकताएँ प्रदर्शित करता है, तो कम संयोजकता के लिए अस (us) व अधिक संयोजकता के लिए इक (ic) तत्त्व के नाम के साथ लगा देते हैं जैसे कॉपर एक संयोजी क्यूप्रस या द्विसंयोजी क्यूप्रिंक कहलाता है। इसे कॉपर (I) आयन व कॉपर (II) आयन द्वारा भी प्रदर्शित करते हैं। Hg+ (मरक्यूरस)को मरकरी (I) आयन व मरक्यूरिक (Hg++) को मरकरी (II) आयन, फेरस (Fe++) को आयरन (II) आयन व फेरिक (Fe+++) को आयरन (III) आयन द्वारा भी प्रदर्शित करते हैं।]
प्रश्न 7.
ऑक्सीजन गैस के कितने ग्रामों में अणुओं की वही संख्या होती है जितनी कि सल्फर डाइऑक्साइड के 16 ग्रामों में होती है? (O = 16 u, S = 32 u)।
उत्तर-
यह समस्या इस तथ्य के प्रयोग से हल होगी कि सभी गैसों के समान मोलों में अणुओं की समान संख्या होती है। पहले हम सल्फर डाइऑक्साइड के 16 ग्रामों को मोलों में परिवर्तित करते हैं।
सल्फर डाइऑक्साइड, SO2 का 1 मोल। = S का द्रव्यमान + 2 ‘O’ का द्रव्यमान = 32 + 2 x 16 = 64 ग्राम
अब, सल्फर डाइऑक्साइड के 64 g = 1 मोल
इसलिए, सल्फर डाइऑक्साइड के 16 g = x 16 मोल =
मोल
अब, सल्फर डाइऑक्साइड के मोल में अणुओं की वही संख्या होगी जो ऑक्सीजन के
मोल में होगी।
इसलिए, हमें अब ऑक्सीजन के मोल को ग्रामों में द्रव्यमान में परिवर्तित करना चाहिए।
ऑक्सीजन, O2 का एक मोल = 2 ‘O’ परमाणुओं का द्रव्यमान = 2 x 16 = 32 ग्राम।
अब, ऑक्सीजन का 1 मोल = 32 ग्राम
इसलिए, ऑक्सीजन का मोल = 32 x ग्राम = 8 ग्राम।
अतः ऑक्सीजन के 8 ग्रामों में अणुओं की वही संख्या होगी जितनी कि सल्फर डाइऑक्साइड के 16 ग्रामों में होगी।
प्रश्न 8.
निऑन के कितने ग्रामों में, परमाणुओं की वही संख्या होगी, जो कैल्सियम के 4 ग्रामों में परमाणुओं की संख्या होती है ? (आणविक द्रव्यमान : Ne = 20 u; Ca = 40 u)
उत्तर-
इस प्रकार की समस्याओं को हल करने के लिए हमें याद रखना चाहिए कि सभी तत्त्वों के मोलों की समान संख्या में परमाणुओं की समान संख्या होती है।”
(i) हम पहले कैल्सियम के 4 ग्रामों को मोलों में परिवर्तित करते हैं। हमें दिया गया है कि कैल्सियम का परमाण्विक द्रव्यमान 40 u है, इसलिए कैल्सियम का 1 मोल, 40 ग्राम है।
अब, कैल्सियम के 40 g = 1 मोल
इसलिए, कैल्सियम के 4g = x 4 मोल =
मोल
अब, कैल्सियम के मोल में परमाणुओं की उतनी ही संख्या होगी, जितनी कि निऑन के
मोल में परमाणुओं की संख्या होगी। इसलिए, हमें अब निऑन के
मोलों को ग्रामों में द्रव्यमान में परिवर्तित करना होगा।
(ii) निऑन का परमाण्विक द्रव्यमान 20 u है, इसलिए निऑन का 1 मोल 20 ग्रामों के बराबर होगा।
अब, निऑन का 1 मोल = 20 g
इसलिए, निऑन का मोल = 20 x
g = 2 g
अतः निऑन के 2 ग्राम में परमाणुओं की उतनी ही संख्या होगी, जितनी कि कैल्सियम के 4 ग्रामों में है।
अभ्यास प्रश्न
बहुविकल्पीय प्रश्न
1. नाइट्रोजन का रासायनिक संकेत है
(a) Ni
(b) N2
(c) N+
(d) N
2. सोडियम का रासायनिक संकेत है
(a) SO
(b) Sd
(c) NA
(d) Na
3. निम्नलिखित में से कौन सबसे अधिक भारी है?
(a) सूक्रोस (C12H22O11) के 0.2 मोल
(b) CO) के 2 मोल
(c) CaCO3 के 2 मोल
(d) H2O के 10 मोल
4. निम्नलिखित में से किसमें परमाणुओं की संख्या अधिकतम होती है?
(a) H2O के 18 g
(b) O2 के 18 g
(c) CO2 के 18 g
(d) CH4 के 18 g
5. डाल्टन ने प्रतिपादित किया कि
(a) द्रव्य सूक्ष्म कणों का बना है जिन्हें परमाणु कहते हैं।
(b) परमाणु अविभाज्य है जिनका सृजन व विनाश संभव नहीं है।
(c) किसी तत्त्व के सभी परमाणु समान रासायनिक प्रकृति के होते हैं।
(d) उपर्युक्त सभी।
6. हाइड्रोजन परमाणु की त्रिज्या है
(a) 10-6 m
(b) 10-10 m
(c) 1 mm
(d) 1010 m.
7. 1 nm बराबर है
(a) 10-6 m के
(b) 10-10 m
(c) 10-9 m के
(d) 1010 m के
8. कैल्सियम का प्रतीक है
(a) Cu
(b) Cl
(c) Ca
(d) Cm
9. यदि ऑक्सीजन का परमाणु द्रव्यमान 16 है तो ऑक्सीजन गैस के 1 मोल का द्रव्यमान होगा
(a) 44u
(b) 32 ग्राम
(c) 16 u
(d) 16 ग्राम
10. पानी का ग्राम अणु द्रव्यमान है
(a) 18 u
(b) 18 ग्राम
(c) 32 u
(d) 32 ग्राम
11. 1.6 g CH4 का STP पर आयतन होगा
(a) 2.24 L
(b) 4.48 L
(c) 11.2 L
(d) 1.12 L
12. A2+ व B– के संयोजन से बने यौगिक का सूत्र है
(a) A2B
(b) A2B2
(c) AB
(d) AB2
13. Al3+ व से बने यौगिक का सूत्र है
(a) Al2(SO4)3
(b) Al(SO4)3
(c) Al3(SO4)2
(d) AlSO4
14. O2 की परमाणुकता है|
(a) 4
(b) 3
(c) 2
(d) 1
15. कॉपर की परमाणुकता है|
(a) 4
(b) 3
(d) 1
16. आयरन का प्रतीक है
(a) I
(b) Ir
(c) Fe
(d) Fn
17. C प्रतीक है
(a) कार्बन का
(b) कॉपर का
(c) कैल्सियम का
(d) क्लोरीन का
18. किसी यौगिक के 1 मोल में अणुओं की संख्या होगी
(a) 6.022 x 1024
(b) 6.022 x 1022
(c) 6.022 x 1021
(d) 6.022 x 1023
19. यदि जल का अणु द्रव्यमान 18 u है तो 1.8 ग्राम जल में अणुओं की संख्या होगी
(a) 6.022 x 1024
(b) 6.022 x 1022
(c) 6.022 x 1021
(d) 6.022 x 1023
20. H2 गैस के 2 मोलों का द्रव्यमान होगा
(a) 2 ग्राम
(b) 1 ग्राम
(c) 4 ग्राम
(d) 4 u
21. CO2 का ग्राम अणु द्रव्यमान है
(a) 44
(b) 44u
(c) 44 ग्राम
(d) उपर्युक्त सभी
उत्तरमाला
- (b)
- (d)
- (c)
- (d)
- (d)
- (b)
- (c)
- (c)
- (b)
- (b)
- (a)
- (d)
- (a)
- (c)
- (d)
- (c)
- (a)
- (d)
- (b)
- (c)
- (b)