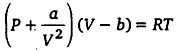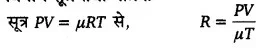NCERT Solutions Class 11 भौतिकी विज्ञान Chapter-13 (अणुगति सिद्धान्त)
Class 11 (भौतिकी विज्ञान )
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
पाठ-13 (अणुगति सिद्धान्त)
प्रश्न 1.
ऑक्सीजन के अणुओं के आयतन और STP पर इनके द्वारा घेरे गए कुल आयतन का अनुपात ज्ञात कीजिए। ऑक्सीजन के एक अणु का व्यास 3Å लीजिए।
उत्तर :
आवोगाद्रो की परिकल्पना के अनुसार S T P पर गैस के 1 मोल द्वारा घेरा गया आयतन
V = 22.4 लीटर = 22.4 x 10-3 मी3
तथा 1 ग्राम मोल में अणुओं की संख्या = आवोगाद्रो संख्या
N = 6.02 x 1023
ऑक्सीजन के एक अणु की त्रिज्या
r = व्यास/2 = 3 Å/2= 1.5 x 10-10 मी
∴ ऑक्सीजन के एक अणु का आयतन
प्रश्न 2.
मोलर आयतन, STP पर किसी गैस (आदर्श) के 1 मोल द्वारा घेरा गया आयतन है। (STP:1 atm दाब, 0°C ताप)। दर्शाइए कि यह 22.4 लीटर है।
उत्तर :
S.T.P. का अर्थ P = 1 वायुमण्डलीय दाब = 1.013 x 105 न्यूटन-मीटर-2
तथा T = 0+273 = 273 K है तथा R = 8.31 जूल/मोल-K
∴ (1 मोल के लिए) आदर्श गैस समीकरण PV = RT से ।
= 22.395 x 10-3 मी-3 ≈ 22.4 लीटर
प्रश्न 3.
चित्र-13.1 में ऑक्सीजन के 100 x 10-3kg द्रव्यमान के लिए PV/T एवं P में, दो अलग-अलग तापों पर ग्राफ दर्शाए गए हैं।
(a) बिन्दुकित रेखा क्या दर्शाती है?
(b) क्या संत्य है : T1 > T2 अथवा T1 < T2?
(c) y-अक्ष पर जहाँ वक्र मिलते हैं वहाँ का मान क्या है?
(d) यदि हम ऐसे ही ग्राफ 100 x 10-3 kg हाइड्रोजन के लिए बनाएँ तो भी क्या उस बिन्दु पर जहाँ वक़ y-अक्ष से मिलते हैं का मान यही होगा? यदि नहीं, तो हाइड्रोजन के कितने द्रव्यमान के लिए
का मान (कम दाब और उच्च ताप के क्षेत्र के लिए वही होगा? H2 का अणु द्रव्यमान = 2.02 u, O2 का अणु द्रव्यमान = 32.0 u, R = 8.31 J mol-1K-1)
उत्तर :
(a) बिन्दुकित रेखा यह दर्शाती है, कि राशि नियत है। यह तथ्य केवल आदर्श गैस के लिए सत्य है; अतः बिन्दुकित रेखा आदर्श गैस का ग्राफ है।
(b) हम देख सकते हैं कि ताप T2 पर ग्राफ की तुलना में ताप T1 पर गैस का ग्राफ आदर्श गैस के ग्राफ के अधिक समीप है अर्थात् ताप T2 पर ऑक्सीजन गैस का आदर्श गैस के व्यवहार से विचलन अधिक है।
हम जानते हैं कि वास्तविक गैसें निम्न ताप पर आदर्श गैस के व्यवहार से अधिक विचलित होती है।
अतः T1 > T2
(c) जिस बिन्दु पर ग्राफ y-अक्ष पर मिलते हैं ठीक उसी बिन्दु से आदर्श गैस का ग्राफ भी गुजरता है;
अतः इस बिन्दु पर ऑक्सीजन गैस, आदर्श गैस समीकरण का पालन करेगी।
अत: PV = µRT से, = µR
∵ गैस का द्रव्यमान m= 1.00 x 10-3 kg जबकि गैस का ग्राम अणुभार M = 32g
(d) इस बिन्दु पर गैस, आदर्श गैस समीकरण का पालन करेगी; अतः = µR होगा। परन्तु समान द्रव्यमान हाइड्रोजन गैस में ग्राम-अणुओं की संख्या भिन्न होगी; अत: हाइड्रोजन गैस के लिए
का मान भिन्न होगा।
H2 गैस के लिए = µR का वही मान प्राप्त करने के लिए हमें ग्राम-अणुओं की संख्या वही
लेनी होगी।
प्रश्न 4.
एक ऑक्सीजन सिलिण्डर जिसका आयतन 30 L है, में ऑक्सीजन का आरम्भिक दाब 15 atm एवं ताप 27°c है। इसमें से कुछ गैस निकाल लेने के बाद प्रमापी (गेज) दाब गिरकर 11 atm एवं ताप गिरकर 17°C हो जाता है। ज्ञात कीजिए कि सिलिण्डर से ऑक्सीजन की कितनी मात्रा निकाली गई है? (R = 8.31 J mol-1K-1, ऑक्सीजन का अणु द्रव्यमान O2 = 32u )
उत्तर :
μ ग्राम मोल के लिए आदर्श गैस समीकरण
PV = μ RT (जहाँ μ = m/M)
अतः PV= (m/M) RT
(जहाँ m= ग्राम में द्रव्यमान, M = ग्राम में अणुभार)
प्रश्न 5.
वायु का एक बुलबुला, जिसका आयतन 1.0 cm3 है, 40 m गहरी झील की तली से जहाँ ताप 12°c है, उठकर ऊपर पृष्ठ पर आता है जहाँ ताप 35°c है। अब इसका आयतन क्या होगा?
उत्तर :
दिया है : बुलबुले का आयतन V1 = 1.0 cm3 = 1.0 x 10-6m3
अन्तिम आयतन V2 = ?
प्रश्न 6.
एक कमरे में, जिसकी धारिता 25.0 m3 है, 27°C ताप और 1 atm दाब पर, वायु के कुल अणुओं (जिनमें नाइट्रोजन, ऑक्सीजन, जलवाष्प और अन्य सभी अवयवों के कण सम्मिलित हैं) की संख्या ज्ञात कीजिए।
उत्तर :
दिया है : कमरे की धारिता V = 25.0 m3, ताप T = 27 + 273 = 300K,
दाब P = 1 atm = 1.01 x 105 N m-2
कुल अणुओं की संख्या = ?
प्रश्न 7.
हीलियम परमाणु की औसत तापीय ऊर्जा का आकलन कीजिए-
(i) कमरे के ताप (27°C) पर।
(ii) सूर्य के पृष्ठीय ताप (6000 K) पर।
(iii) 100 लाख केल्विन ताप (तारे के क्रोड का प्रारूपिक ताप) पर।
उत्तर :
हीलियम एक परमाणु गैस है। अत: परमाणु की औसत तापीय ऊर्जा अणु की औसत तापीय ऊर्जा ही होगी। किसी गैस के एक अणु की औसत तापीय ऊर्जा (गतिज ऊर्जा) (जहाँ T = परमताप,
प्रश्न 8.
समान धारिता के तीन बर्तनों में एक ही ताप और दाब पर गैसे भरी हैं। पहले बर्तन में निऑन (एकपरमाणुक) गैस है, दूसरे में क्लोरीन (द्विपरमाणुक) गैस है और तीसरे में यूरेनियम हेक्साफ्लोराइड (बहुपरमाणुक) गैस है। क्या तीनों बर्तनों में गैसों के संगत अणुओं की संख्या समान है? क्या तीनों प्रकरणों में अणुओं की υr.m.s (वर्ग-माध्य-मूल चाल) समान है?
उत्तर :
(i) हाँ, चूँकि आवोगाद्रो परिकल्पना के अनुसार समान परिस्थितियों में गैसों के समान आयतन में अणुओं की संख्या समान होती है। (ii) नहीं,
तीनों गैसों के ग्राम-अणु भार अलग-अलग हैं; अतः अणुओं की वर्ग-माध्य-मूल चाल भी अलग-अलग होगी।
प्रश्न 9.
किस ताप पर ऑर्गन गैस सिलिण्डर में अणुओं की υr.m.s,-20°C पर हीलियम गैस परमाणुओं की υr.m.s के बराबर होगी? (Ar का परमाणु द्रव्यमान = 39.9u एवं हीलियम का परमाणु द्रव्यमान = 4.0u)
उत्तर :
प्रश्न 10.
नाइट्रोजन गैस के एक सिलिण्डर में, 2.0 atm दाब एवं 17°C ताप पर, नाइट्रोजन अणुओं के माध्य मुक्त पथ एवं संघट्ट आवृत्ति का आकलन कीजिए। नाइट्रोजन अणु की त्रिज्या लगभग 1.0 Å लीजिए। संघट्ट-काल की तुलना अणुओं द्वारा दो संघट्टों के बीच स्वतन्त्रतापूर्वक चलने में लगे समय से कीजिए। (नाइट्रोजन का आणविक द्रव्यमान = 28.0u)
उत्तर :
P = 2.0, वायुमण्डलीय = 2 x 1.013 x 105 = 2.026 x 105 न्यूटन मीटर-2,
T = 17°C = 17 + 273 = 290 K
1 मोल गैस के लिए, PV = RT
अतिरिक्त अभ्यास
प्रश्न 11.
1 मीटर लम्बी संकरी (और एक सिरे पर बन्द) नली क्षैतिज रखी गई है। इसमें 76 cm लम्बाई भरा पारद सूत्र, वायु के 15 cm स्तम्भ को नली में रोककर रखता है। क्या होगा यदि खुला सिरा नीचे की ओर रखते हुए नली को ऊर्ध्वाधर कर दिया जाए?
उत्तर :
प्रारम्भ में जब नली क्षैतिज है, तब बन्द सिरे पर रोकी गई वायु का दाब वायुमण्डलीय दाब के बराबर होगा क्योंकि यह वायु, वायुमण्डलीय दाब के विरुद्ध पारे के स्तम्भ को पीछे हटने से रोकती है।
∴ P1 = वायुमण्डलीय दाब
= 76 सेमी पारद स्तम्भ का दाब
यदि नली का अनुप्रस्थ क्षेत्रफल A सेमी² है तो वायु का आयतन V1 = 15 सेमी X A सेमी² = 15A सेमी3 । जब नली का खुला सिरा नीचे की ओर रखते हुए ऊध्र्वाधर करते हैं तो खुले सिरे पर बाहर की ओर से वायुमण्डलीय दाब (76 सेमी पारद स्तम्भ का दाब) काम करता है जब कि ऊपर की ओर से 76 सेमी पारद सूत्र का दाब तथा बन्द सिरे पर एकत्र वायु की दाब काम करते हैं। चूँकि खुले सिरे पर पारद स्तम्भ + वायु का दाब अधिक है अतः पारद स्तम्भ सन्तुलन में नहीं रह पाता और नीचे गिरते हुए, वायु को बाहर निकाल देता है।
माना पारद स्तम्भ की h लम्बाई नली से बाहर निकल जाती है।
तब, पारद स्तम्भ की शेष ऊँचाई = (76 – h)
सेमी जबकि बन्द सिरे पर वायु स्तम्भ की लम्बाई = (15 + 9 + h) सेमी
= (24 + h) सेमी
वायु का आयतन V2 = (24 + h) A सेमी3
अतः h = 23.8 सेमी अथवा – 47.8 सेमी (जो अनुमान्य है।)
इसलिए h = 23.8 सेमी ≈ 24 सेमी ।
अतः लगभग 24 सेमी पारा बाहर निकल जायेगा। शेष पारे का 52 सेमी ऊँचा स्तम्भ तथा 4.8 सेमी वायु स्तम्भ इसमें जुड़कर बाह्य वायुमण्डल के साथ संतुलन में रहते हैं। (यहाँ पूरे प्रयोग की अवधि में ताप को नियत माना गया है तब ही बॉयल के नियम का प्रयोग किया है।)
प्रश्न 12.
किसी उपकरण से हाइड्रोजन गैस 28:7 सेमी3/से की दर से विसरित हो रही है। उन्हींस्थितियों में कोई दूसरी गैस 7.2 सेमी3/से की दर से विसरित होती है। इस दूसरी गैस को पहचानिए।
[संकेत-ग्राहम के विसरण नियम R1/R2 = (M2 /M1)1/2 का उपयोग कीजिए, यहाँ R1, R2 क्रमशः गैसों की विसरण दर तथा M1 एवं M2 उनके आणविक द्रव्यमान हैं। यह नियम अणुगति सिद्धान्त का एक सरल परिणाम है।]
उत्तर :
किसी गैस के विसरण की दर । गैस अणुओं के वर्ग माध्य मूल वेग के अनुक्रमानुपाती होती है अर्थात्
अतः दूसरी गैस ऑक्सीजन है। (चूंकि ऑक्सीजन का अणुभार 32 होता है।)
प्रश्न 13.
साम्यावस्था में किसी गैस का घनत्व और दाब अपने सम्पूर्ण आयतन में एकसमान हैं। यह पूर्णतया सत्य केवल तभी है जब कोई भी बाह्य प्रभाव न हो। उदाहरण के लिए गुरुत्व से प्रभावित किसी गैस स्तम्भ का घनत्व (और दाब) एकसमान नहीं होता है। जैसा कि आप आशा करेंगे इसका घनत्व ऊँचाई के साथ घटता है। परिशुद्ध निर्भरता ‘वातावरण के नियम
से दी जाती है, यहाँ n2, n1 क्रमशः h2 व h1 ऊँचाइयों पर संख्यात्मक घनत्व को प्रदर्शित करते हैं। इस सम्बन्ध का उपयोग द्रव-स्तम्भ में निलम्बित किसी कण के अवसादने साम्य के लिए समीकरण
को व्युत्पन्न करने के लिए कीजिए, यहाँ ρ निलम्बित कण का घनत्व तथा ρ’ चारों तरफ के माध्यम का घनत्व है। NA आवोगाव्रो संख्या तथा R सार्वत्रिक गैस नियतांक है। (संकेतः निलम्बित कण के आभासी भार को जानने के लिए आर्किमिडीज के सिद्धान्त का उपयोग कीजिए)
उत्तर :
वातावरण के नियम के अनुसार,
जबकि m द्रव्यमान का कण वायु में साम्यावस्था में तैर रहा है। यदि कण ρ’ वाले किसी द्रव में छोड़ा गया है तो इस कण पर द्रव के कारण उत्क्षेप भी कार्य करेगा। ऐसी स्थिति में हमें उक्त सूत्र में mg के स्थान पर कण का आभासी भार रखना होगा।
माना कण का आयतन V तथा घनत्व ρ है तब ।
कण का आभासी भार = mg – उत्क्षेप
प्रश्न 14.
नीचे कुछ ठोसों व द्रवों के घनत्व दिए गए हैं। उनके परमाणुओं की आमापों का आकलन (लगभग) कीजिए।
[ संकेतः मान लीजिए कि परमाणु ठोस अथवा द्रव प्रावस्था में दृढ़ता से बँधे हैं, तथा आवोगाव्रो संख्या के ज्ञात मान का उपयोग कीजिए। फिर भी आपको विभिन्न परमाणवीय आकारों के लिए अपने द्वारा प्राप्त वास्तविक संख्याओं का बिल्कुल अक्षरशः प्रयोग नहीं करना चाहिए क्योंकि दृढ़ संवेष्टन सन्निकटन की रूक्षता के परमाणवीय आकार कुछ Å के पास में हैं ]
उत्तर :
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
27°C ताप पर एक बर्तन में भरी हुई एक मोल हाइड्रोजन गैस का दाब P है। उसी आयतन के दूसरे बर्तन में 127°C ताप पर एक मोल हीलियम गैस भरी है। इसका दाब होगा
उत्तर :
(iii)
प्रश्न 2.
किसी बर्तन में P0 दाब पर गैस है। यदि सभी अणुओं के द्रव्यमान आधे और उनकी चाल दोगुनी कर दी जाये तो परिणामी दाब होगा
(i) 4P0
(ii) 2P0
(iii) P0
(iv) P0/2
उत्तर :
(ii) 2P0
प्रश्न 3.
सामान्य ताप एवं दाब पर 1 सेमी3 हाइड्रोजन एवं 1 सेमी3 ऑक्सीजन गैसें ली गयी हैं। हाइड्रोजन के अणुओं की संख्या n1 तथा ऑक्सीजन के अणुओं की संख्या n2 है। सही विकल्प होगा
उत्तर :
(i)
प्रश्न 4.
एक आदर्श गैस का दाब P और इसके एकांक आयतन की गतिज ऊर्जा E में परस्पर सम्बन्ध है।
उत्तर :
(iii)
प्रश्न 5.
एक ग्राम-अणु गैस की गतिज ऊर्जा सामान्य ताप तथा दाब पर E है। 273°C पर इसकी गतिज ऊर्जा होगी।
(i)
(ii)
(iii) 2E
(iv) 4E
उत्तर :
(iii) 2E
प्रश्न 6.
किसी वास्तविक गैस के लिए P तथा v में परिवर्तन चार विभिन्न तपों T1, T2, T3 व T4 पर प्रदर्शित है। गैस का क्रान्तिक ताप है। विभिन्न तापों T1, T2, T3 तथा T4 पर किसी वास्तविक गैस का दाब P बढ़ाने पर आयतन v में परिवर्तन चित्र 13.3 में प्रदर्शित है। गैस का क्रान्तिक ताप है।
(i) T1
(ii) T2
(iii) T3
(iv) T4
उत्तर :
(ii) T2
प्रश्न 7.
40°C पर किसी गैस के अणुओं की औसत गतिज ऊर्जा है। वह ताप, जिस पर यह ऊर्जा 2E हो जाएगी, है।
(i) 80°C
(ii) 160° C
(ii) 273°C
(iv) 353°C
उत्तर :
(i) 80°C
प्रश्न 8.
1 मोल नाइट्रोजन गैस के दाब व ताप बदल जाते हैं । जब प्रयोग को उच्च दाब तथा उच्च ताप पर किया 2.0 जाता है। प्राप्त परिणाम चित्र 13.4 में प्रदर्शित है। का P के साथ सही परिवर्तन प्रदर्शित होगा
(i) वक्र 1 से
(ii) वक्र 4 से।
(iii) वक्र 3 से
(iv) वक्र 2 से
उत्तर :
(ii) वक्र 4 से
प्रश्न 9.
कमरे के ताप पर हाइड्रोजन तथा ऑक्सीजन के अणुओं की वर्ग-माझ्य-मूल चालों का अनुपात है
(i) 4:1
(ii) 8:1
(iii) 12:1
(iv) 16:1
उत्तर :
(i) 4:1
प्रश्न 10.
किसी गैस का परमताप चार गुना बढ़ा दिया जाता है। गैस के अणुओं की वर्ग-माध्य-मूल चाल हो जायेगी।
(i) 4 गुना
(ii) 16 गुना
(iii) 1/4 गुना
(iv) 2 गुना
उत्तर :
(iv) 2 गुना
प्रश्न 11.
दो आदर्श गैसों के अणुओं के वर्ग-माध्य-मूल वेग समान हैं। गैसों के अणुभार क्रमशः M1 और M2 एवं परमताप क्रमशःT1 और T2 हैं तो,
उत्तर :
(ii)
प्रश्न 12.
समान ताप पर दो गैसों के वाष्प घनत्वों का अनुपात 4 : 5 है। इनके अणुओं के वर्ग-माध्य-मूल वेगों का अनुपात होगा।
(i) 1 : 2.25
(ii) 2:3
(iii)3:2
(iv) 4:9
उत्तर :
(iii) 3 : 2
प्रश्न 13.
एक पक्षी आकाश में उड़ रहा है। इसके गति की स्वातन्त्र्य कोटि की संख्या है।
(i) 3
(ii) 2
(iii) 1
(iv) 0
उत्तर :
(i) 3
प्रश्न 14.
किसी द्विपरमाणविक अणु की स्थानान्तरीय तथा घूर्णीय स्वातन्त्र्य कोटियों की कुल संख्या होगी
(i) 2
(ii) 3
(iii) 4
(iv) 5
उत्तर :
(iv) 5
प्रश्न 15.
किसी एकपरमाणविक गैस के एक अणु की स्वातन्त्र्य कोटियों की संख्या होगी।
(i) 1
(ii) 2
(iii) 3
(iv) 4
उत्तर :
(iii) 3
प्रश्न 16.
एक चींटी मेज के पृष्ठ पर चल रही है। इसके चलने की स्वातन्त्रय कोटि है।
(i) शून्य
(ii) 1
(iii) 2
(iv) 3
उत्तर :
(iii) 2
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
आदर्श गैस का अवस्था समीकरण किसे कहते हैं?
उत्तर :
किसी आदर्श गैस के निश्चित द्रव्यमान के आयतन, ताप व दाब में सम्बन्ध बताने वाले समीकरण को आदर्श गैस समीकरण या आदर्श गैस को अवस्था समीकरण कहते हैं।
प्रश्न 2.
वास्तविक गैसों के लिए वाण्डरवाल्स समीकरण लिखिए तथा प्रमुख प्रतीकों के अर्थ बताइए।
उत्तर :
वास्तविक गैसों के लिए वाण्डरवाल्स समीकरण निम्न है।
जहाँ P = दाब, V = आयतन, R = सार्वत्रिक गैस नियतांक
a तथा b = त्रुटि सुधार नियतांक
प्रश्न 3.
अणुगति सिद्धान्त के आधार पर गैस के दाब का सूत्र लिखिए। प्रयुक्त संकेतांकों का अर्थ लिखिए।
उत्तर :
जहाँ m = एक अणु का द्रव्यमान,n = V आयतन में अणुओं की संख्या तथा = अणुओं का वर्ग-माध्य-मूल वेग।
प्रश्न 4.
दो गैसें समान ताप, दाब तथा आयतन पर मिश्रित की गयी हैं। यदि तप्प और आयतन में । परिवर्तन न हो तो मिश्रण का परिणामी दाब क्या होगा?
उत्तर :
डाल्टने के आंशिक दाब के अनुसार परिणामी दाब = P1 + P2
परन्तु यहाँ P1 = P2 = P (माना) अतः परिणामी दाब = P+ P = 2P
अतः मिश्रण का दाब एक गैस के दाब का दोगुना होगा।
प्रश्न 5.
1 सेमी3 ऑक्सीजन और 1 सेमी3 नाइट्रोजन सामान्य ताप एवं दाब पर हैं। इन गैसों में अणुओं की संख्याओं का अनुपात क्या है?
उत्तर :
अणुगति सिद्धान्त से,
चूँकि दोनों एक ही ताप पर हैं, अत: अणुओं की माध्य गतिज ऊर्जाएँ बराबर होंगी। तब
प्रश्न 6.
किसी ठोस को दबाने पर उनके परमाणुओं की स्थितिज ऊर्जा घटती है अथवा बढ़ती है।
उत्तर :
बढ़ती है।
प्रश्न 7.
किसी गैस के दाब तथा प्रति एकांक आयतन की गतिज ऊर्जा में सम्बन्ध स्थापित कीजिए।
उत्तर :
गैसों के अणुगति सिद्धान्त के अनुसार
प्रश्न 8.
किस ताप पर किसी गैस के अणुओं की माध्य गतिज ऊर्जा 27°C ताप पर गतिज ऊर्जा की 1/3 होगी?
उत्तर :
चूँकि
प्रश्न 9.
किसी गैस के परमताप को चार गुना बढ़ा दिया गया। इसके अणुओं के वर्ग-माध्य-मूल वेग में क्या परिवर्तन होगा?
उत्तर :
∴ νrms ∝ √t; यदि परमताप को 4 गुना बढ़ा देने से वर्ग-माध्य-मूल वेग √4 गुना अर्थात् 2 गुना बढ़ जायेगा।
प्रश्न 10.
किसी गैस में ध्वनि की चाल तथा उसकी गैस के अणुओं की वर्ग-माध्य-मूल चाल (νrms) में सम्बन्ध का सूत्र लिखिए।
उत्तर :
लनु उत्तरीय प्रश्न
प्रश्न 1.
अणुगति सिद्धान्त के आधार पर बॉयल तथा चाल्र्स के नियमों की व्याख्या कीजिए।
उत्तर :
बॉयल के नियम की व्याख्या-अणुगति सिद्धान्त से एक निश्चित द्रव्यमान की गैस द्वारा आरोपित दाब
प्रश्न 2.
किसी गैस को सम्पीडित करने में किये गये कार्य को समझाइए।
उत्तर :
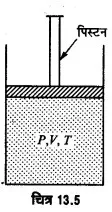
गैस को सम्पीडित करने में किया गया कार्य-माना एक आदर्श गैस एक पिस्टन लगे सिलिण्डर में भरी है, गैस का दाब P, आयतन V तथा ताप T है, जब गैस को सम्पीडित किया जाता है, तो उसके लिए μ मोलों के लिए आदर्श गैस समीकरण । PV = μT से,= μR का मान नियत रहता है। गैस को सम्पीडित करने में गैस पर कुछ कार्य करना पड़ता है। यदि P दाब पर गैस का आयतन dV कम हो जाये, तो गैस पर कृत कार्य,
dw = PdV
गैस का आयतन V1 से V2 तक सम्पीडित करने में गैस पर किया गया कार्य
कृत कार्य का मान गैस को सम्पीडित करने के प्रक्रम पर भी निर्भर करता है। उदाहरण के लिए, समदाबी, समतापी व रुद्धोष्म प्रक्रमों में कृत कार्य भिन्न-भिन्न होते हैं। यदि गैस वास्तविक है, तो गैस को सम्पीडित करने में अन्तरआण्विक बलों के विरुद्ध भी कार्य करना पड़ता है।
प्रश्न 3.
अन्तरिक्ष के किसी क्षेत्र में प्रति घन सेमी में औसतन केवल 5 अणु हैं तथा वहाँ ताप 3 है। उस क्षेत्र में गैस का दाब क्या है? बोल्ट्ज मैन नियतांक R= 1.38 x 10-23 जूल/K
उत्तर :
यदि गैस के किसी द्रव्यमान में n अणु हों तब गैस के इस द्रव्यमान के लिए निम्नलिखित समीकरण होगी
प्रश्न 4.
एक बर्तन में भरी गैस का ताप 400 Kहै और दाब 2.78 x 10-3 न्यूटन/भी2 है। बर्तन के 1 सेमी3 आयतन में अणुओं की संख्या ज्ञात कीजिए। बोल्ट्जमैन नियतांक K = 1.38 x 10-23 जूल/केल्विन।
उत्तर :
आदर्श गैस समीकरण PV = nKBT से,
प्रश्न 5.
वायु से भरे हुए एक कमरे का आयतन 41.4 मी3 है। वायु का ताप 27°C तथा दाब 1.0 x 105 न्यूटन/मी2 है। वायु के कुल अणुओं की संख्या ज्ञात कीजिए।
उत्तर :
आदर्श गैस समीकरण PV = nKBT से,
प्रश्न 6.
क्रान्तिक ताप के आधार पर वाष्प तथा गैस में अन्तर स्पष्ट कीजिए।
उत्तर :
वाष्प तथा गैस दोनों ही किसी पदार्थ की गैसीय अवस्था के दो नाम हैं। इनमें अन्तर यह है कि जो पदार्थ साधारण ताप व दाब पर द्रव या ठोस अवस्था में होते हैं उनके गैसीय अवस्था में आ जाने पर उनको वाष्प कहते हैं; जैसे—कपूर की वाष्प, जलवाष्प आदि। परन्तु जो पदार्थ साधारण ताप व दाब पर ही गैसीयं अवस्था में होते हैं, वे गैस कहलाते हैं। उदाहरणार्थ-वायु, ऑक्सीजन आदि। गैस को दाब डालकर द्रवित करने के लिए पहले उसे क्रान्तिक ताप तक ठण्डा करना पड़ता है, परन्तु वाष्प को केवल दाब डालकर ही द्रवित किया जा सकता है। अतः क्रान्तिक ताप से ऊपर पदार्थ गैस तथा नीचे वाष्प की भाँति व्यवहार करता है।
प्रश्न 7.
दिखाइए कि गैस के अणुओं का वर्ग-माध्य-मूल वेग गैस के परमताप के वर्गमूल के अनुक्रमानुपाती होता है।
उत्तर :
गैस के अणुओं के वेगों के वर्गों का माध्य का वर्गमूल, गैस के अणुओं का वर्ग-माध्य-मूल वेग कहलाता है। उसे νrms से प्रदर्शित करते हैं।
अत: किसी गैस के अणुओं का वर्ग-माध्य-मूल वेग गैस के परमताप के वर्गमूल के अनुक्रमानुपाती होता है।
प्रश्न 8.
27°C पर ऑक्सीजन (आणविक भार = 32) के लिए अणुओं का वर्ग-माध्य-मूल वेग तथा 4 ग्राम गैस की गतिज ऊर्जा भी ज्ञात कीजिए। (गैस नियतांक R = 8.31 जूल/मोल-K)
उत्तर :
T = 27°C = 27 + 273 = 300 K, M = 32
प्रश्न 9.
किसी गैस का प्रारम्भिक ताप – 73°c है। इसे किस ताप तक गर्म करना चाहिए जिससे
(i) गैस के अणुओं का वर्ग-माध्य-मूल वेग दोगुना हो जाये?
(ii) अणुओं की औसत गतिज ऊर्जा दोगुनी हो जाए?
उत्तर :
प्रारम्भिक परमताप T1 = (-73 + 273) K = 200 K; माना इसको t2°C तक गर्म किया जाना चाहिए जिसका संगत परमताप T2K.
प्रश्न 10.
यदि किसी गैस का ताप 127°C से बढ़ाकर 527°C कर दिया जाये तो उसके अणुओं का वर्ग-माध्य-मूल वेग कितना हो जायेगा?
उत्तर :
प्रश्न 11.
किस ताप पर ऑक्सीजन के अणुओं का औसत वेग पृथ्वी से पलायन कर जाने के लिए पर्याप्त होगा? पृथ्वी का पलायन वेग = 11.2 किमी/से, ऑक्सीजन के एक अणु का द्रव्यमान = 5.34 x 10-26 किग्रा, बोल्ट्जमैन नियतांक K = 1.38 x 10-23 जूल/K
उत्तर :
माना ऑक्सीजन के एक अणु का द्रव्यमान m है। अणु की पलायन ऊर्जा होगी, जहाँ ve पृथ्वी से पलायन करने का वेग है।
अणुगति सिद्धान्त के अनुसार, TK ताप पर एक अणु की माध्य गतिजऊर्जा होती है, जहाँ KB बोल्ट्जमैन नियतांक है।
प्रश्न 12.
4.0 ग्राम ऑक्सीजन गैस की 27°C ताप पर कुल आन्तरिक ऊर्जा की गणना कीजिए। (ऑक्सीजन गैस की स्वातन्त्रय कोटियों की संख्या 5 तथा गैस नियतांक R = 2.0 कैलोरी/मोल-केल्विन है)
उत्तर :
विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
आदर्श गैस समीकरण PV = RT स्थापित कीजिए तथा R का विमीय सूत्र एवं मात्रक ज्ञात कीजिए।
आदर्श गैस के अवस्था समीकरण की सहायता से गैस नियतांक (R) का विमीय-सूत्र ज्ञात कीजिए।
उत्तर :
आदर्श गैस समीकरण—किसी आदर्श गैस के निश्चित द्रव्यमान के आयतने, ताप व दाब में सम्बन्ध बतलाने वाले समीकरण को आदर्श गैस समीकरण अथवा आदर्श गैस का अवस्था समीकरण (equation of state) कहते हैं।
माना आदर्श गैस की प्रारम्भिक अवस्था में इसके निश्चित द्रव्यमान के दाब, आयतन व ताप क्रमशः P1 V1 तथा T1 हैं। किसी अन्य अवस्था में इनके मान बदलकर माना P2, V2 तथा T2 हो जाते हैं। गैस की अवस्था में होने वाले इस परिवर्तन को निम्न दो पदों में पूर्ण हुआ माना जा सकता है|
(i) ताप नियत रखते हुए यदि ताप T1 स्थिर रखते हुए दाब P1 से बदलकर P2 कर दिया जाए। तथा आयतन V1 से बदलकर V’ हो जाए तो बॉयल के नियम से
P1V1 = P2V’
अथवा V’= P1V1/P2 …(1)
(ii) दाब नियत रखते हुए-यदि दाब P2 नियत रखते हुए परमताप T1 से बदलकर T2 कर दिया जाये तो आयतन V’ से बदलकर V2 हो जायेगा। अत: चार्ल्स के नियम के अनुसार,
यही गैस समीकरण है। नियतांक । को विशिष्ट गैस नियतांक (specific gas constant) कहते हैं। इसका मान गैस की प्रकृति तथा द्रव्यमान पर निर्भर करता है, अर्थात् भिन्न-भिन्न गैसों के एक ही द्रव्यमान के लिए अथवा एक ही गैस के भिन्न-भिन्न द्रव्यमानों के लिए इसका मान भिन्न-भिन्न होता है। यदि हम एक ग्राम-अणु अर्थात् 1मोल गैस लें तो गैस-नियतांकr का मान सभी गैसों के लिए बराबर होगा। तब इसको सार्वत्रिक-गैस-नियतांक (universal gas constant) कहते हैं तथा । इसे R से व्यक्त करते हैं।
अतः 1 मोल अर्थात् 1 ग्राम-अणु गैस के लिए समीकरण (3) को नया रूप निम्नलिखित होगा
PV = RT …(4)
समीकरण (4) गैस-नियमों के आधार पर प्राप्त की गयी है। चूंकि गैस के नियम एक आदर्श गैस के लिए पूर्णत: सत्य हैं; अतः समीकरण PV = RT भी एक आदर्श गैस के 1 ग्राम मोल के लिए पूर्णतः सत्य होगी। अतः इसको आदर्श गैस समीकरण कहते हैं। R का विमीय सूत्र तथा मात्रक,
प्रश्न 2.
गैस के अणुगति सिद्धान्त की परिकल्पनाओं का उल्लेख कीजिए।
उत्तर :
गैस के अणुगति सिद्धान्त की परिकल्पनाएँ-गैसों का अणुगति सिद्धान्त निम्नलिखित परिकल्पनाओं पर आधारित है–
1. प्रत्येक गैस छोटे-छोटे कणों से मिलकर बनी होती है जिन्हें अणु कहते हैं।
2. किसी गैस के अणु दृढ़, पूर्णतः प्रत्यास्थ (perfectly elastic), गोलाकार व सभी प्रकार से एकसमान होते हैं।
3. अणुओं का आकार अत्तराणुक अन्तराल की तुलना में नगण्य होता है। अतः अणुओं का अपना आयतन गैस के आयतचे की तुलना में नगण्य होता है।
4. साधारणत: अणुओं के बीच किसी प्रकार का बल नहीं लगता; अत: ये नियत चाल से ऋजु-रेखीय पथों पर गति करते हैं। परन्तु जब दो अणु एक-दूसरे के अत्यन्त निकट आ जाते हैं तो उनके बीच प्रतिकर्षण बल कार्य करने लगता है जिससे उनकी चाल तथा गति की दिशा बदल जाती है। फलस्वरूप, अणु नये सरल रेखीय पथ पर गति प्रारम्भ करते हैं। इस घटना को दो अणुओं के बीच ‘टक्कर’ (collision) कहते हैं। अत: दो क्रमागत टक्करों के बीच गैस के अणु सरल रेखा में गति करते हैं। दो क्रमागत टक्करों के बीच गैस के अणु द्वारा तय की गयी औसत दूरी को ‘औसत मुक्त पथ’ (mean free path) कहते हैं। इस प्रकार अणु सभी सम्भव वेग से सभी सम्भव दिशाओं में अनियमित गति करते हैं।
5. ये अणु बर्तन की दीवारों से टकराते हैं किन्तु इन टक्करों से गैस का आयतन नहीं बदलता अर्थात् गैस के प्रति एकांक आयतन में अणुओं की संख्या स्थिर रहती है।
6. दो अणुओं की टक्कर पूर्णतः प्रत्यास्थ होती है। टक्कर के समय उनके मध्य आकर्षण या प्रतिकर्षण बल नहीं लगता जिससे टक्कर में गतिज ऊर्जा संरक्षित रहती है।
7. दो अणुओं की टक्कर क्षणिक होती है अर्थात् टक्कर का समय उनके द्वारा स्वतन्त्रतापूर्वक चलने | में लिए गये समय की तुलना में नगण्य होता है।
8. अणुओं की गति पर गुरुत्वाकर्षण के प्रभाव को नगण्य माना जा सकता है। अतः गुरुत्वाकर्षण बल के कारण भी अणुओं के वितरण पर कोई प्रभाव नहीं पड़ता।
प्रश्न 3.
आदर्श गैस समीकरण लिखिए। वास्तविक गैसों के लिए वाण्डर वाल्स के संशोधनों को समझाइए तथा इससे संशोधित गैस समीकरण प्राप्त कीजिए।
उत्तर :
आदर्श गैस समीकरण-1 मोल गैस के लिए आदर्श गैस समीकरण है PV = RT, जहाँ P = दाब,V = आयतन, R = गैस नियतांक तथा T = परमताप है।
वाण्डर वाल्स गैस समीकरण-बॉयल के नियमानुसार, स्थिर ताप पर गैस के एक निश्चित द्रव्यमान के लिए दाब (P) व्र आयतन (V) का गुणनफल PV एक नियतांक होता है। प्रयोगों द्वारा देखा गया है। कि कोई भी वास्तविक गैस इस नियम का पूर्णतः पालन नहीं करती। उच्च दाबों तथा निम्न तापों पर गैस बॉयल के नियम से बहुत अधिक विचलित हो जाती है। अतः वाण्डर वाल्स ने वास्तविक गैसों के इस व्यवहार की व्याख्या करने के लिए आदर्श मॉडल में निम्न लिखित दो संशोधन किये
1. अणुओं का अशून्य आकार (Finite size of molecules)–आदर्श गैस समीकरण PV = RT को प्राप्त करने में यह माना गया था कि गैस के अणुओं का आयतन, गैस के आयतन V की तुलना में नगण्य है तथा गैस का सम्पूर्ण आयतन अणुओं की गति के लिए उपलब्ध है। परन्तु सभी अणुओं का आयतन कुछ स्थान घेरता है जिससे आदर्श गैस के आयतन का प्रभावी आयतन (V – b) होगा, जहाँ । एक नियतांक है। अत: हम आदर्श गैस समीकरण PV = RT में v के स्थान पर (V – b) रखेंगे।
2. अन्तरा-अणुक बल (Inter-molecular force)–आदर्श गैस मॉडल में यह भी माना गया था कि गैस के अणुओं के मध्ये कोई बल आरोपित नहीं होता। यह मान्यता वास्तविक गैसों पर लागू नहीं होती है। गैस का प्रत्येक अणु दूसरे अणु पर बल लगाता है जिसे अन्तर आणविक बल कहते हैं। साधारण दाबों पर गैस के अणु बहुत दूर-दूर होते हैं; अत: उनके बीच अन्तर आणविक बल लगभग शून्य होता है। दाब बढ़ने के साथ-साथ अणु भी पास-पास आ जाते हैं और वे एक-दूसरे को आकर्षित करने लगते हैं। बर्तन के मध्य स्थित अणु (जैसे P) पर चारों ओर से आकर्षण बल कार्य करते हैं; अत: उस पर कोई प्रभावी बल नहीं लगता। जो अणु दीवार के पास होता है उस पर एक बल अन्दर की ओर लगता है, जिससे दीवार के टकराते समय उसके संवेग में कुछ कमी आ जाती है। अतः अणु द्वारा दीवार पर आरोपित बल आदर्श गैस मॉडल में प्राप्त बल से कम होता है। इसके फलस्वरूप दीवार पर वास्तविक गैस का दाब, आदर्श गैस के दाब से कम होता है। यदि यह कमी β है तो आदर्श गैस समीकरण में P के स्थान पर (P + β) रखेंगे। β का मान दीवार के समीप अंणु को आकर्षित करने वाले अणुओं की प्रति एकांक आयतन में संख्या पर तथा दीवार के प्रति एकांक क्षेत्रफल पर प्रति सेकण्ड टकराने वाले अणुओं की संख्या पर निर्भर करता है। ये दोनों ही गैस के घनत्व के अनुक्रमानुपाती होते हैं।
प्रश्न 4.
गैसों के अणु गतिज सिद्धान्त के आधार पर किसी आदर्श गैस के दाब का सूत्र लिखिए और इसके आधार पर बॉयल के नियम की व्याख्या कीजिए।
उत्तर :
गैसों के गतिज सिद्धान्त के आधार पर किसी आदर्श गैस का दाब सूत्र निम्नवत् है
बॉयल का नियम इस नियम के अनुसार, नियत ताप पर किसी गैस के एक निश्चित द्रव्यमान का आयतन V उसके दाब P के व्युत्क्रमानुपाती होता है।
PV = नियतांक …(1)
इस प्रकार, यदि हम किसी गैस के ताप को नियत रखते हुए उसके दाब को दोगुना कर दें तो उसका आयतन आधा रह जायेगा अथवा दाब को आधा कर देने पर आयतन दोगुना हो जायेगा।
व्यापक रूप में, नियत ताप पर किसी दिये गये द्रव्यमान की गैस के प्रारम्भिक दाब व आयतन P1 व V1 हों तथा अन्तिम दाब व आयतन P2 व V2 हों, तो बॉयल के नियम से, P1V1 = P2V2, चित्र 13.7 में किसी गैस के लिए विभिन्न नियत तापों T1, T2, व T3 (T1 > T2 > T3) पर P तथा v के बीच प्रायोगिक वक्र तथा सैद्धान्तिक वक्र तुलना के लिए साथ-साथ दर्शाये गये हैं। बिन्दुकित वक्र समीकरण (1) के आधार पर खींचे गये हैं जो सैद्धान्तिक वक्र दर्शाते हैं, जबकि चिकने (smooth line) वक्र प्रायोगिक रूप से P तथा V के प्राप्त मानों के आधार पर खींचे गये हैं। इनसे यह स्पष्ट है कि निम्न दाब तथा उच्च ताप पर सैद्धान्तिक तथा प्रायोगिक वक्रों में संगति स्पष्ट दृष्टिगोचर होती है, परन्तु उच्च दाबों तथा निम्न तापों पर उनमें बहुत अधिक विचलन पाया जाता है। इसका कारण यह है कि निम्न दाबों तथा उच्च तापों पर गैस के अणु दूर-दूर होते हैं और उनके बीच अन्तरआणविक बल उपेक्षणीय होते हैं। अन्तरआणविक बलों की अनुपस्थिति में गैस आदर्श गैस की तरह व्यवहार करती है। इस प्रकार, दाब व ताप की सभी अवस्थाओं में गैसें बॉयल के नियम का पूर्ण रूप से पालन नहीं करती , हैं, केवल निम्न दाब तथा उच्च ताप पर ही वे ऐसा करती हैं।
प्रश्न 5.
गैसों के अणुगति सिद्धान्त के आधार पर किसी आदर्श गैस के दाब का व्यंजक लिखिए तथा इसकी सहायता से अणुओं की गतिज ऊर्जा तथा गैस के ताप में सम्बन्ध स्थापित कीजिए।
उत्तर :
दाब
आणविक गतिज ऊर्जा एवं ताप में सम्बन्ध–माना किसी गैस के 1 ग्राम-अणु (1 मोल) का द्रव्यमान अर्थात् अणुभार M तथा इसके अणुओं का वेग-वर्ग-माध्य है तो
अर्थात् औसत गतिज ऊर्जा प्रारम्भिक औसत गतिज ऊर्जा की दोगुनी हो जायेगी।
प्रश्न 6.
माध्य-मुक्त पथ के लिए व्यंजक का निगमन कीजिए।
उत्तर :
माध्य-मुक्त पथ के लिए व्यंजक-माना कि किसी बर्तन में एक अणु के अतिरिक्त अन्य सभी अणु स्थिर हैं। माना कि प्रत्येक अणु d व्यास का गोला है। गतिशील अणु उन सभी अणुओं से टकरायेगा जिनके केन्द्र इसके केन्द्र से d दूरी पर स्थित होंगे [चित्र-13.8 (a)]।
माना कि एक बर्तन में गैस भरी है तथा उसके प्रति एकांक आयतन में n अणु हैं। प्रत्येक अणु का व्यास d है। माना इस गैस का केवल एक अणु ७ वेग से गतिमान है तथा शेष सभी अणु स्थिर हैं। गतिमान अणु उन सभी अणुओं से टकरायेगा जिनके केन्द्र इसके केन्द्र से d दूरी पर हैं [चित्र 13.8 (b)]। ∆t समय में इस अणु द्वारा चली दूरी = v ∆t. अतः ∆t समय में यह अणु उन सभी अणुओं से टकराएगा जो d त्रिज्या तथा ) v ∆t लम्बाई के सिलिण्डर में हैं।
सिलिण्डर का आयतन = πd²v∆t
सिलिण्डर में अणुओं की संख्या = (πd²v∆t) x n
यह गतिशील अणु द्वारा ∆t समय में अन्य अणुओं से टक्करों की संख्या है। गतिशील अणु ∆t समय में v∆t दूरी तय करता है। अतः अणु का ।